湖南省张家界市慈利县201-2019学年高一下学期化学期中考试试卷
试卷更新日期:2019-05-16 类型:期中考试
一、选择题(本题共18小题,每小题3分,共54分。每小题只有一个选项符合题意。)
-
1. 能源可划分为一次能源和二次能源,直接从自然界取得的能源称为一级能源,一次能源经过加工、转换得到的能源成为二次能源。下列能源中属于一次能源的是( )A、氢能 B、电能 C、核能 D、水煤气2. 下列关于元素周期表的叙述,错误的是( )A、镁是第IIA族元素 B、第IA族元素全部是金属元素 C、氧族中含金属元素 D、第3周期中既有金属元素又有非金属元素3. 下列叙述中,正确的是( )A、14C中含有14个中子 B、1H、2H、3H是同一种核素 C、H2O与D2O(重水)互称同位素 D、C60、金刚石、石墨均为碳的同素异形体4. 放射性无素铱—192可使人的红细胞、白细胞、血小板严重偏低。则 中的中子数为( )A、115 B、38 C、269 D、155. 科学家根据元素周期律和原子结构理论预测,原子序数为114的元素位于第七周期ⅣA族,称为类铅元素。下面关于它的原子结构和性质预测正确的是( )A、类铅元素原子的最外层电子数为6 B、它的最高价氧化物水化物的碱性比铅的最高价氧化物水化物的碱性弱 C、它的金属性比铅强 D、它的原子半径比铅小6. 下列说法正确的是( )A、Br的非金属性比I强,HBr比HI的稳定性强 B、P的原子半径比N大,H3PO4 比HNO3 的酸性强 C、Na熔点比K高, NaOH的碱性比KOH强 D、非金属性Cl>Br>I,沸点HCl>HBr>HI7. 某元素M的气态氢化物的化学式为MH3 , 则M的最高价氧化物为( )A、MO B、M2O3 C、MO2 D、M2O58. 下列物质中含有共价键的离子化合物是( )
①MgCl2 ②Na2O2 ③NaOH ④NH4Cl ⑤CO2 ⑥H2O2 ⑦H2
A、②③④ B、②④⑤⑦ C、①②③④⑥ D、①③⑤⑥9. 下列物质的电子式书写正确的是( ) A、①②③④ B、⑤⑥ C、②③⑤⑥⑦ D、①④10. 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )
A、①②③④ B、⑤⑥ C、②③⑤⑥⑦ D、①④10. 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( ) A、1mol N2(g)和1mol O2(g)完全反应放出的能量为180kJ B、通常情况下,N2(g)和O2(g)混合能直接生成NO C、1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量 D、NO是一种红棕色的气体,能与水反应生成硝酸11. 下列反应中,能量变化如图所示的是( )
A、1mol N2(g)和1mol O2(g)完全反应放出的能量为180kJ B、通常情况下,N2(g)和O2(g)混合能直接生成NO C、1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量 D、NO是一种红棕色的气体,能与水反应生成硝酸11. 下列反应中,能量变化如图所示的是( ) A、碳酸钙受热分解 B、乙醇在空气中燃烧 C、铝粉与盐酸反应 D、氧化钙溶解于水12. 某兴趣小组设计的简易原电池装置如下图所示。该电池工作时,下列说法正确的是( )
A、碳酸钙受热分解 B、乙醇在空气中燃烧 C、铝粉与盐酸反应 D、氧化钙溶解于水12. 某兴趣小组设计的简易原电池装置如下图所示。该电池工作时,下列说法正确的是( ) A、锌片作正极 B、碳棒上有气泡产生 C、可将电能转化为化学能 D、电子由碳棒经滤纸流向锌片13. 下列图示的装置不能形成原电池的是( )A、
A、锌片作正极 B、碳棒上有气泡产生 C、可将电能转化为化学能 D、电子由碳棒经滤纸流向锌片13. 下列图示的装置不能形成原电池的是( )A、 B、
B、 C、
C、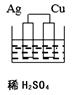 D、
D、 14. 下列对于可逆反应2A(g)+B(g) 2C(g) +3D(g)达到平衡时的说法正确的是( )A、A,B全部转化成了C,D B、反应已经停止 C、反应混合物中各组分的浓度不再改变 D、c (C)∶c(D)=2∶315. 化学反应速率受外界条件如反应温度、反应物浓度、压强、催化剂等的影响.烧烤时,用扇子向红热的木炭扇风,火会更旺,其原因是( )A、使O2浓度增加,反应加快 B、温度降低,反应减慢 C、使CO2 浓度增加,反应加快 D、压强降低,反应减慢16. 将气体A、B置于容积为2L的密闭容器中发生如下反应:4A(g)+B(g) 2C (g),反应进行到4s末,测得A、B、C的物质的量分别为0.5mol、0.4mol、0.2mol。则用反应物B表示该反应的速率为( )A、0.025mol·L -1 ·s -1 B、0.0125 mol·L-1 ·s-1 C、0.05 mol·L-1 ·s-1 D、0.1 mol·L -1 ·s-117. 几种短周期元素的原子半径及主要化合价如表所示:
14. 下列对于可逆反应2A(g)+B(g) 2C(g) +3D(g)达到平衡时的说法正确的是( )A、A,B全部转化成了C,D B、反应已经停止 C、反应混合物中各组分的浓度不再改变 D、c (C)∶c(D)=2∶315. 化学反应速率受外界条件如反应温度、反应物浓度、压强、催化剂等的影响.烧烤时,用扇子向红热的木炭扇风,火会更旺,其原因是( )A、使O2浓度增加,反应加快 B、温度降低,反应减慢 C、使CO2 浓度增加,反应加快 D、压强降低,反应减慢16. 将气体A、B置于容积为2L的密闭容器中发生如下反应:4A(g)+B(g) 2C (g),反应进行到4s末,测得A、B、C的物质的量分别为0.5mol、0.4mol、0.2mol。则用反应物B表示该反应的速率为( )A、0.025mol·L -1 ·s -1 B、0.0125 mol·L-1 ·s-1 C、0.05 mol·L-1 ·s-1 D、0.1 mol·L -1 ·s-117. 几种短周期元素的原子半径及主要化合价如表所示:元素符号
X
Y
Z
R
T
原子半径(nm)
0.160
0.080
0.102
0.143
0.074
主要化合价
+2
+2
-2,+4,+6
+3
-2
根据表中信息,判断以下说法正确的是( )
A、单质与氢气化合的难易程度Z>T B、离子半径:T >X2+>R3+ C、元素最高价氧化物对应水化物的碱性:Y>R>X D、相同条件下,单质与稀硫酸反应的剧烈程度:R>Y>X18. W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。下列说法不正确的是( )A、单质的沸点:W<X B、Y元素的最高正价为+5价 C、最高价氧化物的水化物的酸性:Y<Z D、X与Y不能存在于同一离子化合物中二、填空题(每空2分,共46分)
-
19. 下表是现行中学化学教科书中元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题:
 族
族周期
ⅠA
0
1
H
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
①
②
F
Ne
3
③
Mg
④
Si
⑤
⑥
(1)、②表示的元素是 (填元素符号)。(2)、①与⑤两种元素相比较,原子半径较大的是 (填元素符号),其非金属性较强的是 (填元素符号),其最高正价氧化物水化物酸性较强的酸是 (填分子式)。(3)、⑥元素的单质可以用来制取漂白粉,其有效成分是 (填化学式)。③与⑥两种元素所形成化合物所含化学键是(填“共价键”或“离子键”)。(4)、写出元素③的最高价氧化物对应的水化物与元素④的最高价氧化物对应的水化物相互反应的化学方程式: 。20. A,B,C,D为原子序数依次增大的短周期元素,已知A、B、D三种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4。(1)、写出下列元素符号: B , D(2)、A与D两元素可形成化合物,用电子式表示其化合物的形成过程:。(3)、A在空气中燃烧生成原子个数比为1:1的化合物,写出其电子式为。(4)、元素C的最高价氧化物与元素A的最高价氧化物的水化物反应的离子方程式为。21. 科学家预言,燃料电池将是21世纪获得电能的重要途径。近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子(就是H+)和水分子通过。其工作原理的示意图如下,请回答下列问题: (1)、该装置的能量转化形式为。(2)、Pt(a)电极是电池(填“正”或“负”)极,(3)、电解液中的H+向(填“a”或“b”)极移动。(4)、如果该电池工作时消耗1 mol CH3OH,则电路中通过 mol电子。(5)、比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是燃料电池的能量转化率高,其次是。22. 某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
(1)、该装置的能量转化形式为。(2)、Pt(a)电极是电池(填“正”或“负”)极,(3)、电解液中的H+向(填“a”或“b”)极移动。(4)、如果该电池工作时消耗1 mol CH3OH,则电路中通过 mol电子。(5)、比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是燃料电池的能量转化率高,其次是。22. 某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)实验
序号
实验温度/K
参加反应的物质
溶液颜色褪至无色时所需时间/s
KMnO4溶液(含硫酸)
H2C2O4溶液
H2O
V/mL
c/mol·L-1
V/mL
c/mol·L-1
V/mL
A
293
2
0.02
4
0.1
0
6
B
T1
2
0.02
3
0.1
V1
8
C
313
2
0.02
V2
0.1
1
t1
 (1)、通过实验A、B,可探究出浓度的改变对反应速率的影响,其中V1= , T1=;通过实验可探究出温度变化对化学反应速率的影响。(2)、C组实验中溶液褪色时间t1(填“>”或“<”)8s,C组实验的反应速率v(KMnO4) = 。(用含有t1的式子表示)(3)、该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间变化的趋势如图所示,并以此分析造成n(Mn2+)突变的可能的原因是:。
(1)、通过实验A、B,可探究出浓度的改变对反应速率的影响,其中V1= , T1=;通过实验可探究出温度变化对化学反应速率的影响。(2)、C组实验中溶液褪色时间t1(填“>”或“<”)8s,C组实验的反应速率v(KMnO4) = 。(用含有t1的式子表示)(3)、该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间变化的趋势如图所示,并以此分析造成n(Mn2+)突变的可能的原因是:。