吉林省吉林市2018-2019学年高考理综-化学三模考试试卷
试卷更新日期:2019-05-16 类型:高考模拟
一、选择题
-
1. 化学与资源利用、环境保护及社会可持续发展密切相关。下列说法错误的是( )A、煤转化为水煤气加以利用是为了节约燃料成本 B、利用太阳能蒸发淡化海水的过程属于物理变化 C、在阳光照射下,利用水和二氧化碳合成的甲醇属于可再生燃料 D、用二氧化碳合成可降解塑料聚碳酸酯,实现“碳”的循环利用2. 一种形状像蝴蝶结的有机分子Bowtiediene,其形状和结构如图所示,下列有关该分子的说法中错误的是( )
 A、该分子中所有碳原子在同一平面内 B、生成1molC5H12至少需要4molH2 C、三氯代物只有一种 D、与其互为同分异构体,且只含碳碳三键的链烃有两种3. 用NA表示阿伏加德罗常数的数值,下列说法中不正确的是( )A、20gD2O含有的电子数为10NA B、标准状况下,22.4LCl2通入足量NaOH溶液中,完全反应时转移的电子数为2NA C、1L0.1mol·L-1NH4NO3溶液中的氮原子数为0.2NA D、25℃时,1.0LpH=12的NaClO溶液中由水电离出的OH-的数目为0.01NA4. 下列药品和装置合理且能完成相应实验的是( )
A、该分子中所有碳原子在同一平面内 B、生成1molC5H12至少需要4molH2 C、三氯代物只有一种 D、与其互为同分异构体,且只含碳碳三键的链烃有两种3. 用NA表示阿伏加德罗常数的数值,下列说法中不正确的是( )A、20gD2O含有的电子数为10NA B、标准状况下,22.4LCl2通入足量NaOH溶液中,完全反应时转移的电子数为2NA C、1L0.1mol·L-1NH4NO3溶液中的氮原子数为0.2NA D、25℃时,1.0LpH=12的NaClO溶液中由水电离出的OH-的数目为0.01NA4. 下列药品和装置合理且能完成相应实验的是( )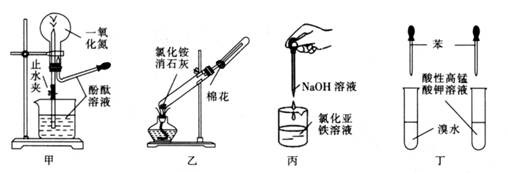 A、甲图为喷泉实验 B、乙图为实验室制取并收集氨气 C、丙图为制备氢氧化亚铁的实验 D、丁图为验证苯中是否有碳碳双键的实验5. 短周期部分元素原子半径与原子序数的关系如图,下列说法正确的是( )
A、甲图为喷泉实验 B、乙图为实验室制取并收集氨气 C、丙图为制备氢氧化亚铁的实验 D、丁图为验证苯中是否有碳碳双键的实验5. 短周期部分元素原子半径与原子序数的关系如图,下列说法正确的是( ) A、相同条件下,Y的氢化物比X的氢化物更稳定,熔沸点也更高 B、A单质通常保存在煤油中 C、Y的单质能从含R简单离子的水溶液中置换出R单质 D、M的最高价氧化物对应水化物能分别与Z、R的最高价氧化物对应水化物反应6. 一种新型电化学装置如图所示:
A、相同条件下,Y的氢化物比X的氢化物更稳定,熔沸点也更高 B、A单质通常保存在煤油中 C、Y的单质能从含R简单离子的水溶液中置换出R单质 D、M的最高价氧化物对应水化物能分别与Z、R的最高价氧化物对应水化物反应6. 一种新型电化学装置如图所示:
装置工作时,下列说法正确的是( )
A、电能转化为化学能 B、Na+向正极区迁移 C、Pt/C极的电极反应式为2CO2+2H2O-2e-=2HCO3- +H2 D、金属钠极上的电势比Pt/C极上的高7. 已知:AG= 室温下用0.01mol·L-1的NH3·H2O滴定20.00mL0.01mol·L-1某一元酸HQ的结果如图所示,下列说法中正确的是( ) A、HQ属于弱酸 B、整个过程中,C点时水的电离程度最大 C、Kb(NH3·H2O)的数量级为10-5 D、E点对应溶液中:c(OH-)+c(NH3·H2O)=c(N )+c(H+)
A、HQ属于弱酸 B、整个过程中,C点时水的电离程度最大 C、Kb(NH3·H2O)的数量级为10-5 D、E点对应溶液中:c(OH-)+c(NH3·H2O)=c(N )+c(H+)二、非选择题
-
8. 二茂铁在常温下为橙黄色粉末,有樟脑气味,用作节能、消烟、助燃添加剂等。可用下列方法合成:

回答下列问题:
(1)、室温下,环戊二烯以二聚体的形式存在。某实验小组要得到环戊二烯,需先将环戊二烯二聚体解聚,已知:
②分离得到环戊二烯的操作为 (填操作名称)。
②由环戊二烯生成C5H5K的化学方程式为
(2)、流程中所需的FeCl2·4H2O可通过下列步骤制得。
①用饱和Na2CO3溶液“浸泡”铁屑的目的是 。
②采用“趁热过滤”,其原因是 。
(3)、用电解法制备二茂铁时:①不断通入N2的目的是。
②Ni电极与电源的(填“正极”或“负极”相连,电解过程中阳极的电极反应式为 , 理论上电路中每转移1mol电子,得到产品的质量为 。
9. 砷及其化合物在半导体、农药制造等方面用途非常广泛。回答下列问题:(1)、AsH3的电子式为 ;AsH3通入AgNO3溶液中可生成Ag、As2O3和HNO3 , 该反应中氧化剂与还原剂的物质的量之比为。(2)、改变0.1mol·L-1三元弱酸H3AsO4溶液的pH,溶液中的H3AsO4、H2AsO4 、HAsO42- 及AsO43- 的物质的量分布分数随pH的变化如图所示:
①lgKal(H3AsO4)=;用甲基橙作指示剂,用NaOH溶液滴定H3AsO4 , 发生的主要反应的离子方程式为。
②反应H2AsO4-+AsO43- 2HAsO42-的lgK= 。
(3)、焦炭真空冶炼砷的其中两个热化学反应如下:As2O3(g)+3C(s)=2As(g)+3C0(g)△H1=akJ·mol-1
As2O3(g)+3C(s)= As4(g)+3CO(g) △H2=bkJ·mol-1
则反应4As(g) As4(g)的△H= kJ·mol-1(用含a、b的代数式表示)。
(4)、反应2As2S3(s) 4AsS(g)+S2(g)达平衡时气体总压的对数值1g(p/kPa)与温度的关系如图所示:
① 对应温度下,B点的反应速率v(正)v(逆)(填““<”或“=。
②A点处,AsS(g)的分压为 kPa,该反应的Kp= kPa5(Kp为以分压表示的平衡常数)。
10. 某校同学设计实验用乙烯与Br2的CCl4溶液反应制备1,2-二溴乙烷。回答下列问题:
(1)、甲组同学设计下列装置制备Br2的CCl4溶液,实验装置如下:
①装置中烧瓶及广口瓶口上的橡皮塞最好用锡箱包住,用橡皮管连接的两玻璃管口要相互紧靠,其目的是 。
②装置C的作用是 。
③烧瓶中主要生成NaHSO4、MnSO4和Br2 , 该反应的化学方程式为。
(2)、乙同学利用甲制得的Br2的CCl4 , 溶液及下列装置制备1,2一二溴乙烷。
已知:1.烧瓶中主要发生的反应为C2H5OH C2H4↑+H2O主要副反应为C2H5OH+6H2SO4(浓) 6SO2↑+2CO2↑+9H2O
Ⅱ.1,2一二溴乙烷的沸点为131.5℃,CCl4的沸点为76.8℃,酸性高锰酸钾溶液会与乙烯反应。
①制得的乙烯经纯化后用于制取1,2-二溴乙烷的四氯化碳溶液并净化尾气(部分装置可重复使用),各玻璃接口连接的顺序为a→(填小写字母)。
②烧瓶中加入碎瓷片的作用是 .
③生成1,2一二溴乙烷的化学方程式为;判断Br2已完全反应的依据是 .
(3)、丙同学设计实验对乙同学得到的混合溶液进行分离提纯,下列玻璃仪器不需要的是(填标号)。 11. [化学——物质结构与性质]
11. [化学——物质结构与性质]钴的合金及其配合物用途非常广泛。已知Co3+比Fe3+的氧化性更强,在水溶液中不能大量存在。
(1)、Co3+的核外电子排布式为。
(2)、无水CoCl2的熔点为735℃、沸点为1049℃,FeCl3熔点为306℃、沸点为315℃。CoCl2属于晶体,FeCl3属于 晶体。
(3)、BNCP可用于激光起爆器等,可由HClO4、CTCN、NaNT共反应制备。①Cl 的空间构型为.
②CTCN的化学式为[CO(NH3)4CO3]NO3 , 与Co(Ⅲ)形成配位键的原子是(已知C 的结构式为
 )。
)。③NaNT可以
 (双聚氰胺)为原料制备。1mol双聚氰胺分子中含σ键的数目为.(4)、Co与CO作用可生成Co2(CO)8 , 其结构如图1所示。该分子中C原子的杂化方式为 。
(双聚氰胺)为原料制备。1mol双聚氰胺分子中含σ键的数目为.(4)、Co与CO作用可生成Co2(CO)8 , 其结构如图1所示。该分子中C原子的杂化方式为 。 (5)、钴酸锂是常见锂电池的电极材料,其晶胞结构如图2所示。该晶胞中氧原子的数目为。已知NA的阿伏加德罗常数的数值,则该晶胞的密度为(用含a、b、NA的代数式表示)g·cm-3。12. [化学——有机化学基础]
(5)、钴酸锂是常见锂电池的电极材料,其晶胞结构如图2所示。该晶胞中氧原子的数目为。已知NA的阿伏加德罗常数的数值,则该晶胞的密度为(用含a、b、NA的代数式表示)g·cm-3。12. [化学——有机化学基础]非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:
 回答下列问题:(1)、A的化学名称是 。(2)、C中含氧官能团的名称为 。(3)、上述反应中,反应①的条件是。(4)、D的分子式为。(5)、过程④属于反应。(6)、反应②发生的是取代反应,且另一种产物有HBr,写出由B生成C的化学方程式: 。(7)、有机物M与非诺洛芬互为同分异构体,M满足下列条件:
回答下列问题:(1)、A的化学名称是 。(2)、C中含氧官能团的名称为 。(3)、上述反应中,反应①的条件是。(4)、D的分子式为。(5)、过程④属于反应。(6)、反应②发生的是取代反应,且另一种产物有HBr,写出由B生成C的化学方程式: 。(7)、有机物M与非诺洛芬互为同分异构体,M满足下列条件:I.能与NaHCO3溶液反应,且能与FeCl3溶液发生显色反应;
Ⅱ.分子中有6种不同化学环境的氢,且分子中含有两个苯环。
M的结构有种,写出其中一种不能与浓水发生取代反应的M的结构简式:。