湖北省宜昌市兴山县2018-2019学年中考化学4月模拟考试试卷
试卷更新日期:2019-05-06 类型:中考模拟
一、单选题
-
1. 空气中含量最多的气体是( )A、氧气 B、氮气 C、二氧化碳 D、水蒸气2. 下列变化中,属于物理变化的是()A、铜生铜绿 B、火药爆炸 C、胆矾研碎 D、蜡烛燃烧3. 下列实验操作错误的是()A、
 倾倒液体
B、
倾倒液体
B、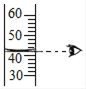 读取液体体积
C、
读取液体体积
C、 稀释浓硫酸
D、
稀释浓硫酸
D、 检查装置气密性
4. 臭氧(O3)主要分布在离地面10~50km的高空,它能吸收空气大部分紫外线,保护地球生物,臭氧属于( )A、纯净物 B、混合物 C、氧气 D、稀有气体5. 从环境保护的角度考虑,下列燃料最理想的是( )A、氢气 B、天然气 C、酒精 D、汽油6. 在海水晒盐过程中,下列说法错误的是()A、把海水引入贮水池时,海水的成分基本不变 B、在蒸发池中进行风吹日晒时,海水中氯化钠的质量分数增大 C、在结晶池中继续风吹日晒时,海水中水的质量逐渐减少 D、析出晶体后的母液是氯化钠的不饱和溶液7. 下列物质的化学式写法错误的是()A、氧化镁写为MgO B、氧化锌写为ZnO C、氧化铁写为FeO D、氧化钙写为CaO8. 土壤的酸碱度会影响植物的生长.下列植物在微酸性土壤中,不适宜种植的是( )
检查装置气密性
4. 臭氧(O3)主要分布在离地面10~50km的高空,它能吸收空气大部分紫外线,保护地球生物,臭氧属于( )A、纯净物 B、混合物 C、氧气 D、稀有气体5. 从环境保护的角度考虑,下列燃料最理想的是( )A、氢气 B、天然气 C、酒精 D、汽油6. 在海水晒盐过程中,下列说法错误的是()A、把海水引入贮水池时,海水的成分基本不变 B、在蒸发池中进行风吹日晒时,海水中氯化钠的质量分数增大 C、在结晶池中继续风吹日晒时,海水中水的质量逐渐减少 D、析出晶体后的母液是氯化钠的不饱和溶液7. 下列物质的化学式写法错误的是()A、氧化镁写为MgO B、氧化锌写为ZnO C、氧化铁写为FeO D、氧化钙写为CaO8. 土壤的酸碱度会影响植物的生长.下列植物在微酸性土壤中,不适宜种植的是( )植物
花生
苹果
西瓜
沙枣
适宜的pH范围
5.0~6.0
5.0~6.5
6.0~7.0
8.0~8.7
A、花生 B、苹果 C、西瓜 D、沙枣9. KClO3中Cl元素的化合价是()A、+4 B、+5 C、+6 D、+710. 下列是某同学进行化学实验时记录的实验现象,其中与事实相符的是()A、将氢氧化钠放在表面皿上,表面逐渐潮湿 B、把CO2气体通入紫色的石蕊溶液,石蕊溶液变蓝色 C、打开盛有浓盐酸的试剂瓶,看到有大量白烟 D、硫在空气中燃烧发出明亮的蓝紫色火焰11. 下列是探究灭火原理的四个实验,其中说法错误的是()实验Ⅰ
 实验Ⅱ
实验Ⅱ  实验Ⅲ
实验Ⅲ 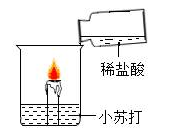
实验Ⅳ
 A、实验Ⅰ中蜡烛熄灭、实验Ⅱ中蜡烛不熄灭,说明隔绝空气可以灭火 B、通过上述实验能得出,灭火原理包括隔绝氧气、降低温度、隔离可燃物 C、实验Ⅲ中蜡烛熄灭,因为稀盐酸与小苏打反应生成二氧化碳隔绝了空气 D、实验Ⅳ中蜡烛熄灭,说明二氧化碳的密度比空气大且不能燃烧不支持燃烧12. 下列固体物质溶于水的过程中,溶液温度显著升高的是()A、氢氧化钠 B、氯化钠 C、硝酸铵 D、蔗糖13. 工业制漂白粉的化学方程式为:2Ca(OH)2+2Cl2=X+CaCl2+2H2O,则X为()A、CaClO B、Ca(ClO)2 C、Ca(ClO)3 D、Ca(ClO)414. 宜昌盛产绿茶,绿茶中含有的茶氨酸(C7H14O3N2)可以降低血压、提高记忆力、保护神经细胞等。下列有关茶氨酸的说法中,错误的是()A、茶氨酸由C,H,O,N四种元素组成 B、每个茶氨酸分子由26个原子构成 C、茶氨酸中含有N2分子 D、茶氨酸中碳元素与氢元素的质量比为6:115. 某同学为了测定生铁样品中铁的质量分数,将60g 稀盐酸分3次加入到盛有4g 该样品的烧杯中(样品中只有铁与稀盐酸反应),所得数据如表,则下列说法中正确的是()
A、实验Ⅰ中蜡烛熄灭、实验Ⅱ中蜡烛不熄灭,说明隔绝空气可以灭火 B、通过上述实验能得出,灭火原理包括隔绝氧气、降低温度、隔离可燃物 C、实验Ⅲ中蜡烛熄灭,因为稀盐酸与小苏打反应生成二氧化碳隔绝了空气 D、实验Ⅳ中蜡烛熄灭,说明二氧化碳的密度比空气大且不能燃烧不支持燃烧12. 下列固体物质溶于水的过程中,溶液温度显著升高的是()A、氢氧化钠 B、氯化钠 C、硝酸铵 D、蔗糖13. 工业制漂白粉的化学方程式为:2Ca(OH)2+2Cl2=X+CaCl2+2H2O,则X为()A、CaClO B、Ca(ClO)2 C、Ca(ClO)3 D、Ca(ClO)414. 宜昌盛产绿茶,绿茶中含有的茶氨酸(C7H14O3N2)可以降低血压、提高记忆力、保护神经细胞等。下列有关茶氨酸的说法中,错误的是()A、茶氨酸由C,H,O,N四种元素组成 B、每个茶氨酸分子由26个原子构成 C、茶氨酸中含有N2分子 D、茶氨酸中碳元素与氢元素的质量比为6:115. 某同学为了测定生铁样品中铁的质量分数,将60g 稀盐酸分3次加入到盛有4g 该样品的烧杯中(样品中只有铁与稀盐酸反应),所得数据如表,则下列说法中正确的是()实验次数
物质质量
第1次
第2次
第3次
加入稀盐酸的质量/g
20
20
20
充分反应后剩余固体的质量
2.6
1.2
0.1
A、第1次和第2次产生氢气的质量不同 B、第2次和第3次剩余固体中均有铁 C、第3次充分反应后溶液中溶质只有FeCl2 D、生铁样品中铁的质量分数为97.5%16. 推理和归纳是研究和学习化学的重要方法。下列说法正确的是()A、碱溶液都能使无色酚酞变红,所以能使无色酚酞变红的都是碱溶液 B、室温下pH<7的溶液呈酸性,所以pH<7的雨水是酸雨 C、化学变化伴随有能量变化,则有能量变化的变化一定是化学变化 D、氧气由氧元素组成,所以制取氧气的反应物一定含有氧元素17. 在探究盐酸的性质时,下列实验中溶液pH的变化符合如图的是()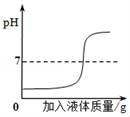 A、向盐酸中加水稀释 B、向盐酸中加入硝酸银溶液 C、向盐酸中加入氯化钠溶液 D、向盐酸中加入氢氧化钠溶液18. 化学学习让我们有了很多收获,下列归纳总结不完全正确的一组是()
A、向盐酸中加水稀释 B、向盐酸中加入硝酸银溶液 C、向盐酸中加入氯化钠溶液 D、向盐酸中加入氢氧化钠溶液18. 化学学习让我们有了很多收获,下列归纳总结不完全正确的一组是()A、保护金属资源
①有计划、合理开采金属矿物
②加强金属制品的回收再利用
③钢铁表面刷上油漆,防止钢铁生锈
B、归纳物质的性质
①汽油、洗涤剂都能溶解油污
②铁丝、红磷都能在空气中燃烧
③氢气、一氧化碳都能还原氧化铜
C、关注实验安全
①不能把鼻孔凑到容器口闻药品
②不能用手接触药品
③不能尝任何药品的味道
D、解释实验现象
①气体压缩,气体分子之间的间隔变小
②溶液长期放置不分层,溶液具有稳定性
③喝汽水打嗝,气体溶解度随温度升高而减小
A、A B、B C、C D、D二、填空题
-
19. 用化学符号表示:(1)、两个氢原子;(2)、氮气;(3)、3个三氧化硫分子;(4)、两个铁离子。20. 碳和碳的氧化物与我们的生活密切相关,请依据图回答问题:
图1
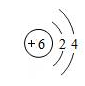 图2
图2  图3
图3  图4
图4  (1)、图1是碳原子结构示意图,其原子核内质子数为 , 该元素在元素周期表中位于第周期。(2)、碳元素组成的不同碳单质有广泛的用途。图2中用到的碳单质是 , 图3中用到的碳单质是 , 图4中用到的碳单质是;不同碳单质物理性质存在明显差异的原因是。(3)、CO和CO2是碳的两种氧化物。
(1)、图1是碳原子结构示意图,其原子核内质子数为 , 该元素在元素周期表中位于第周期。(2)、碳元素组成的不同碳单质有广泛的用途。图2中用到的碳单质是 , 图3中用到的碳单质是 , 图4中用到的碳单质是;不同碳单质物理性质存在明显差异的原因是。(3)、CO和CO2是碳的两种氧化物。CO可作燃料,其在空气中燃烧的化学方程式是。
CO2可制作饮料,其和水反应的化学方程式是。
21. 如图是甲、乙、丙三种固体物质的溶解度曲线,请回答下列问题。 (1)、0℃时,三种物质溶解度最小的是;(2)、t2℃时,甲物质的溶解度是g;(3)、将t1℃时甲、乙、丙三种物质的饱和溶液分别升高到t2℃,有固体析出的是;(4)、t2℃时,将一定质量甲物质加到100g 水中完全溶解,再降温到t1℃,析出甲物质15g,则t2℃时,加入甲物质的质量为g。22. 超细碳酸钙可用于生产钙片、牙膏等产品。利用碳化法生产超细碳酸钙的主要流程示意如下:
(1)、0℃时,三种物质溶解度最小的是;(2)、t2℃时,甲物质的溶解度是g;(3)、将t1℃时甲、乙、丙三种物质的饱和溶液分别升高到t2℃,有固体析出的是;(4)、t2℃时,将一定质量甲物质加到100g 水中完全溶解,再降温到t1℃,析出甲物质15g,则t2℃时,加入甲物质的质量为g。22. 超细碳酸钙可用于生产钙片、牙膏等产品。利用碳化法生产超细碳酸钙的主要流程示意如下: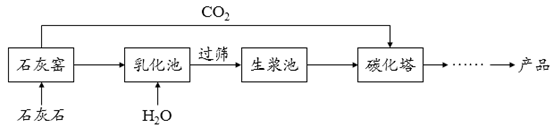 (1)、石灰石主要成分的化学式为。(2)、乳化池中,生石灰与水发生反应,其化学方程式为。(3)、过筛的目的是拦截(填“大于”或“小于”)筛孔直径的颗粒。(4)、碳化塔中反应的化学方程式为。
(1)、石灰石主要成分的化学式为。(2)、乳化池中,生石灰与水发生反应,其化学方程式为。(3)、过筛的目的是拦截(填“大于”或“小于”)筛孔直径的颗粒。(4)、碳化塔中反应的化学方程式为。三、简答题
-
23. 我国已在“可燃冰”开采技术上取得重大突破,从“可燃冰”中可获得甲烷.(1)、甲烷在空气中燃烧的现象是 , 化学方程式是 .(2)、从微观进一步认识化学反应.如图是一定量甲烷和氧气充分反应的微观示意图.
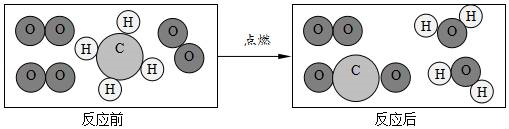
该化学反应中不发生变化的粒子是(填字母序号):
A.碳原子 B.氢原子 C.氧原子 D.甲烷分子 E.氧分子
该微观示意图体现出反应前甲烷和氧气的质量组合可能是(填字母序号).
A.16g甲烷和64g氧气 B.8g甲烷和32g氧气
C.20g甲烷和64g氧气 D.16g甲烷和96g氧气.
四、实验题
-
24. 如图是实验室常用的仪器和装置,据图回答下列问题。
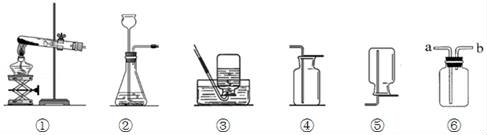 (1)、实验室制取二氧化碳的化学方程式为 , 选择的发生装置为(填数字序号,下同)。(2)、实验室用高锰酸钾制取氧气的化学方程式为;收集氧气和二氧化碳都可以选择的收集装置为 , 理由是。(3)、实验室常用锌和稀硫酸反应制取氢气,若用装置⑥来收集氢气,则气体应由端(填“a”或“b”)导入。
(1)、实验室制取二氧化碳的化学方程式为 , 选择的发生装置为(填数字序号,下同)。(2)、实验室用高锰酸钾制取氧气的化学方程式为;收集氧气和二氧化碳都可以选择的收集装置为 , 理由是。(3)、实验室常用锌和稀硫酸反应制取氢气,若用装置⑥来收集氢气,则气体应由端(填“a”或“b”)导入。五、科学探究题
-
25. 金属是我们身边常见的物质,下列是对金属性质的研究,请分析回答问题:(1)、金属铝比铁活泼,但铁在空气中易生锈,而铝和铝合金的抗腐蚀性能很好的原因用化学方程式表示为。(2)、把铁粉加入到硝酸铜和硝酸银的混合溶液中充分反应后过滤得到滤渣和滤液,为了探究滤渣和滤液的成分,设计了以下实验,并做出假设,请你根据假设分析成分:
操作
假设
结论
滤渣
滴加稀盐酸
若有气泡产生
①则滤渣中一定有 , 滤液中的溶质为。
若无气泡产生
②则滤渣中一定有;滤液中一定有 , 可能有。
(3)、把铁粉加入到混合溶液中一定会发生的反应方程式是 , 该反应的基本反应类型为。六、流程题
-
26. “酸、碱和盐的溶解性表(室温)”是学习化学的重要工具,智慧小组同学利用该工具进行探究学习。部分酸、碱和盐的溶解性表(室温)
阴离子
阳离子
OH﹣
NO3﹣
Cl﹣
SO42﹣
CO32﹣
K+
乙
丁
戊
Ba2+
甲
丙
探究活动一:认识工具
如上图,表中标注了甲、乙、丙、丁和戊五种物质,物质的溶解性均未标明。
(1)、认识符号:NO3﹣名称是;(2)、物质分类:五种物质中,属于碱的是(用化学式表示);(3)、溶解能力:五种物质中,只有一种不溶于水,它是(用化学式表示);(4)、相互反应:五种物质中,在溶液中能相互反应的两种物质是(用化学式表示)。(5)、探究活动二:运用工具已知某氯化钠样品中,含有不溶性杂质(泥沙)和可溶性杂质(氯化镁、氯化钙)。为了得到纯净的氯化钠,某实验小组设计了下列实验方案,请你完成相关问题:
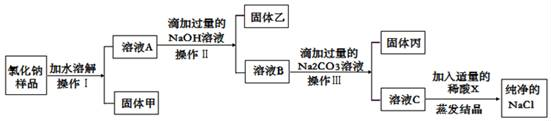
在上述实验方案中,操作Ⅰ、操作Ⅱ、操作Ⅲ都是将固体和溶液分离,该操作是实验基本操作中的。
(6)、固体乙是 , 溶液B中的溶质有。(都用化学式表示)(7)、通过上述设计可以看出,除去氯化钠中的可溶性杂质,实质上就是加入试剂把溶液中的(填离子符号)转化为难溶于水的物质,再进行分离而除去。在溶液C中加入适量的稀酸X是为了把加入的过量试剂反应掉,写出其中一个反应的化学方程式。七、计算题
-
27. 某化学实验小组在做中和反应实验时,取10%的氢氧化钠溶液40克于烧杯中,向其中滴加20%的稀硫酸,直至溶液呈中性。计算:(1)、所加稀硫酸的质量为多少克?(2)、反应完全后,所得溶液中溶质的质量分数是多少?
-
-
-
-