2016-2017学年湖南省五市十校联考高一下学期期中化学试卷
试卷更新日期:2017-05-15 类型:期中考试
一、选择题
-
1. 日本福岛核电站发生核泄漏,对周围土地、海域产生影响.我国东部沿海地区先后检测出放射性物质131I,含量较低,对人们的生活、健康没有造成影响.下列对131I的叙述错误的是( )A、131I的质量数为131 B、1mol 131I的质量为131 C、131I原子核外有5个电子层 D、131I核外最外层电子数为7e﹣2. 下列物质中,既含离子键又含极性共价键的是( )A、NaCl B、H2 C、H2O D、NaOH3. 设NA表示阿伏加德罗常数,下列叙述正确的是( )A、22.4L氘(D2)气体,含有中子数为2NA B、1.6gNH2﹣离子所含电子数为NA C、4g氦气所含分子数为0.5NA D、NA个SO3分子在标准状况下的体积为22.4L4. 下列有关化学用语表达不正确的是( )A、Na的原子结构示意图:
 B、含有6个质子和7个中子的碳元素的核素符号: C
C、氮气的电子式:N:N:
D、用电子式表示氧化钠的形成过程:
B、含有6个质子和7个中子的碳元素的核素符号: C
C、氮气的电子式:N:N:
D、用电子式表示氧化钠的形成过程:  5. 下列结论错误的是( )A、氢化物的稳定性:HF>HCl>H2S>PH3>SiH4 B、微粒半径:K+>Al3+>S2﹣>Cl﹣ C、酸性:HClO4>H2SO4>H3PO4>H2SiO3 D、金属性:K>Ca>Mg>Be6. 砷为第4周期第ⅤA族元素,根据它在元素周期表中的位置推测,砷不可能具有的性质是( )A、砷在通常情况下是固体 B、可以存在﹣3、+3、+5等多种化合价 C、As2O5对应水化物的酸性比H3PO4弱 D、AsH3的稳定性比PH3强7. 有一未完成的离子方程式:( )+RO32﹣+6H+=3R+3H2O,据此判断,R元素的最高价氧化物对应的水化物的化学式为( )A、H2RO3 B、H2RO4 C、HRO3 D、HRO48. 下列各元素的氧化物中,既能与盐酸反应生成盐和水,又能与NaOH溶液反应生成盐和水的是( )A、元素X:位于元素周期表中的第三周期Ⅲ A 族 B、元素Y:它的二价阳离子核外电子总数与氖原子相同 C、元素Z:它的原子中M层比L层少2个电子 D、元素W:它的化合物的焰色反应颜色呈黄色9. 下列关于如图所示原电池装置的叙述中,正确的是( )
5. 下列结论错误的是( )A、氢化物的稳定性:HF>HCl>H2S>PH3>SiH4 B、微粒半径:K+>Al3+>S2﹣>Cl﹣ C、酸性:HClO4>H2SO4>H3PO4>H2SiO3 D、金属性:K>Ca>Mg>Be6. 砷为第4周期第ⅤA族元素,根据它在元素周期表中的位置推测,砷不可能具有的性质是( )A、砷在通常情况下是固体 B、可以存在﹣3、+3、+5等多种化合价 C、As2O5对应水化物的酸性比H3PO4弱 D、AsH3的稳定性比PH3强7. 有一未完成的离子方程式:( )+RO32﹣+6H+=3R+3H2O,据此判断,R元素的最高价氧化物对应的水化物的化学式为( )A、H2RO3 B、H2RO4 C、HRO3 D、HRO48. 下列各元素的氧化物中,既能与盐酸反应生成盐和水,又能与NaOH溶液反应生成盐和水的是( )A、元素X:位于元素周期表中的第三周期Ⅲ A 族 B、元素Y:它的二价阳离子核外电子总数与氖原子相同 C、元素Z:它的原子中M层比L层少2个电子 D、元素W:它的化合物的焰色反应颜色呈黄色9. 下列关于如图所示原电池装置的叙述中,正确的是( ) A、铜片是负极 B、氢离子在铜片表面被还原 C、电流从锌片经导线流向铜片 D、铜片质量逐渐减少10. 下列变化中,未破坏化学键的是( )A、HCl溶于水 B、烧碱受热熔化 C、碘的升华 D、CaO溶于水11. 在N2+3H2⇌2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol/L,在此时间内用N2表示的反应速率为0.30mol/(L•s).则此一段时间是( )A、1秒 B、2秒 C、0.44秒 D、1.33秒12. 某学生欲通过实验判断A、B、C三块金属的活动性,做了如下实验并得结论:当A与B组成原电池时,A 为电池的正极;当B与C组成原电池时,电流方向为由B到C,据此可知这三种金属的活动性强弱顺序为( )A、A>B>C B、A>C>B C、C>B>A D、B>C>A13. 在一密闭容器中进行反应:2SO2(g)+O2(g) 2SO3(g).已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4mol/L、0.2mol/L、0.4mol/L.当反应达到平衡时,可能存在的数据是( )A、SO2为0.8mol/L,O2为0.4 mol/L B、SO2为0.5 mol/L C、SO3为0.8 mol/L D、SO2、SO3均为0.3 mol/L14. 可逆反应:2NO2 2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是:①单位时间内生成n molO2的同时生成2n molNO2②用NO2、NO、O2的物质的量浓度变化表示的反应速率比为2:2:1的状态③混合气体的颜
A、铜片是负极 B、氢离子在铜片表面被还原 C、电流从锌片经导线流向铜片 D、铜片质量逐渐减少10. 下列变化中,未破坏化学键的是( )A、HCl溶于水 B、烧碱受热熔化 C、碘的升华 D、CaO溶于水11. 在N2+3H2⇌2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol/L,在此时间内用N2表示的反应速率为0.30mol/(L•s).则此一段时间是( )A、1秒 B、2秒 C、0.44秒 D、1.33秒12. 某学生欲通过实验判断A、B、C三块金属的活动性,做了如下实验并得结论:当A与B组成原电池时,A 为电池的正极;当B与C组成原电池时,电流方向为由B到C,据此可知这三种金属的活动性强弱顺序为( )A、A>B>C B、A>C>B C、C>B>A D、B>C>A13. 在一密闭容器中进行反应:2SO2(g)+O2(g) 2SO3(g).已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4mol/L、0.2mol/L、0.4mol/L.当反应达到平衡时,可能存在的数据是( )A、SO2为0.8mol/L,O2为0.4 mol/L B、SO2为0.5 mol/L C、SO3为0.8 mol/L D、SO2、SO3均为0.3 mol/L14. 可逆反应:2NO2 2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是:①单位时间内生成n molO2的同时生成2n molNO2②用NO2、NO、O2的物质的量浓度变化表示的反应速率比为2:2:1的状态③混合气体的颜色不再改变的状态④混合气体的密度不再改变的状态⑤混合气体的平均摩尔质量不再改变的状态 ⑥混合气体的压强不再改变的状态( )
A、①②③④ B、③④⑤⑥ C、①③⑤⑥ D、全部15. 等质量并且均过量的两份锌粉a和b(粉末表面积可视为相同,分别加入等体积等物质的量浓度的稀硫酸中,同时向a中加入少量硫酸铜,图表示产生H2的体积(V)与时间(t)的关系正确的是( )A、 B、
B、 C、
C、 D、
D、 16. 若某ⅡB族元素原子序数为x,那么原子序数为x+1的元素位于( )A、Ⅲ B族 B、Ⅲ A族 C、Ⅰ B族 D、Ⅰ A族17. 已知反应A+B=C+D的能量变化如图所示,下列说法正确的是( )
16. 若某ⅡB族元素原子序数为x,那么原子序数为x+1的元素位于( )A、Ⅲ B族 B、Ⅲ A族 C、Ⅰ B族 D、Ⅰ A族17. 已知反应A+B=C+D的能量变化如图所示,下列说法正确的是( ) A、反应物的总能量高于生成物的总能量 B、该反应只有在加热条件下才能进行 C、该反应为放热反应 D、该反应为吸热反应18. 取一定质量的Cu2O和CuO混合粉末,将其均匀混合后分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为( )A、3.6mol/L B、3.2mol/L C、2.8mol/L D、2.4mol/L
A、反应物的总能量高于生成物的总能量 B、该反应只有在加热条件下才能进行 C、该反应为放热反应 D、该反应为吸热反应18. 取一定质量的Cu2O和CuO混合粉末,将其均匀混合后分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为( )A、3.6mol/L B、3.2mol/L C、2.8mol/L D、2.4mol/L二、非选择题,本大题共6小题
-
19. 短周期元素A、B、C、D、E、F的原子序数逐渐增大,A和B同周期,A和F同族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的简单阴离子与C、D、E的简单阳离子电子层结构相同.请回答下列有关问题:(1)、F在元素周期表中的位置是 .(2)、C2B2的电子式是;AB2的结构式是 .(3)、B、C、D、E离子半径由大到小的顺序为(用离子符号回答);
C、D、E最高价氧化物对应水化物的碱性由强到弱的顺序为(用化学式表示,且用“>”符号连接回答).
(4)、C、E最高价氧化物对应水化物能够相互反应,则反应的离子方程式为 .20. 某校化学学习小组设计了两组实验来探究元素周期律.一组同学为验证卤素单质氧化性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验).

实验过程及现象:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸.
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹.
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a.
Ⅳ.打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡.静
置后CCl4层溶液变为紫红色.
请回答下列有关问题:
(1)、验证氯气的氧化性强于碘的实验现象是 .(2)、B和C仪器口盛放浸有NaOH溶液的棉花的作用 .(3)、过程Ⅲ实验的目的是 .(4)、由此实验得出的结论:同主族元素从上到下,原子半径逐渐增大,得电子能力逐渐 (填“减弱”或“增强”).21. 一组同学设计了如图装置来一次性完成验证C、Si、S非金属性强弱的实验研究.
 (1)、A中所盛溶液的名称是 .(2)、B仪器的名称是 .(3)、烧杯C中发生反应的离子方程式为 .22. 某学习小组依据氧化还原反应:2Ag++Cu═Cu2++2Ag设计成的原电池如图所示,则负极发生的电极反应为;当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4g,则该原池反应共转移了的电子数目是 .
(1)、A中所盛溶液的名称是 .(2)、B仪器的名称是 .(3)、烧杯C中发生反应的离子方程式为 .22. 某学习小组依据氧化还原反应:2Ag++Cu═Cu2++2Ag设计成的原电池如图所示,则负极发生的电极反应为;当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4g,则该原池反应共转移了的电子数目是 .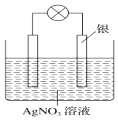 23. 草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO4﹣+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)
23. 草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO4﹣+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)用4mL0.001mol•L﹣1KMnO4溶液与2mL0.01mol•L﹣1H2C2O4溶液,研究反应的温度、反应物的浓度与催化剂等因素对化学反应速率的影响.改变的条件如表所示:
组别
10%硫酸体积/mL
温度/℃
其他物质
Ⅰ
2
20
Ⅱ
2
20
10滴饱和MnSO4溶液
Ⅲ
2
30
Ⅳ
1
20
1mL蒸馏水
(1)、该反应中氧化剂和还原剂的物质的量之比为 .(2)、实验Ⅰ和Ⅱ可得出的结论:影响化学反应速率的因素是;如果研究温度对化学反应速率的影响,使用实验Ⅰ和(Ⅰ~Ⅳ表示).(3)、实验Ⅳ中加入1mL蒸馏水的目的是 .24. 在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)⇌3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为6mol,用D表示的化学反应速率v(D)为0.4mol/(L•min).请回答下列有关问题:(1)、5min末A的物质的量浓度为 .(2)、前5min内用B表示的化学反应速率v(B)为 .(3)、化学方程式中n值为 .(4)、此反应在四种不同情况下的反应速率分别为:①v(A )=5mol/( L•min ) ②v( B )=6mol/( L•min )
③v(C)=4.5mol/( L•min ) ④v(D )=8mol/( L•min )
其中反应速率最快的是(填编号).