2017年江苏省南通市高考化学全真模拟试卷(二)
试卷更新日期:2017-05-15 类型:高考模拟
一、单项选择题
-
1. 《中华人民共和国安全生产法》指出安全生产工作应当以人为本,坚持安全发展、预防为主、综合治理的方针.下列做法不正确的是( )A、面粉生产车间应严禁烟火 B、NH3泄露时向空中喷洒水雾 C、含Cl2的尾气用碱溶液处理后再排放 D、金属钠失火时应立即用大量冷水扑灭2. 下列有关钠元素及其化合物的表示正确的是( )A、钠原子的结构示意图:
 B、过氧化钠的电子式:
B、过氧化钠的电子式:  C、小苏打在水中的电离方程式:NaHCO3═Na++HCO3﹣
D、硫化钠的水溶液呈碱性的原因:S2﹣+2H2O⇌H2S+2OH﹣
3. 下列有关物质的性质与用途具有对应关系的是( )A、氨气具有还原性,可用作制冷剂 B、氢氟酸具有弱酸性,可用于蚀刻玻璃 C、浓硫酸具有脱水性,可用于干燥CO2 D、二氧化氯具有强氧化性,可用来漂白织物4. 短周期主族元素X、Y、Z、W的原子序数依次递增,四种原子最外层电子数之和为18,X与Z同主族,Y原子的最外层电子数等于周期数,W的单质在常温下为气体.下列说法正确的是( )A、原子半径的大小顺序:r(Z)>r(Y)>r(X) B、简单氢化物的稳定性:W>Z C、元素X的单质只存在两种同素异形体 D、X、Y、W最高价氧化物对应的水化物两两之间能发生反应5. 下列指定反应的离子方程式正确的是( )A、向H2O中通入 NO2:3NO2+H2O═H++NO3﹣+2NO B、向Na2SiO3溶液中通入少量SO2:Na2SiO3+SO2+H2O═H2SiO3↓+2Na++SO32﹣ C、用饱和纯減溶液洗涤试管中残留的苯酚:CO32﹣+2
C、小苏打在水中的电离方程式:NaHCO3═Na++HCO3﹣
D、硫化钠的水溶液呈碱性的原因:S2﹣+2H2O⇌H2S+2OH﹣
3. 下列有关物质的性质与用途具有对应关系的是( )A、氨气具有还原性,可用作制冷剂 B、氢氟酸具有弱酸性,可用于蚀刻玻璃 C、浓硫酸具有脱水性,可用于干燥CO2 D、二氧化氯具有强氧化性,可用来漂白织物4. 短周期主族元素X、Y、Z、W的原子序数依次递增,四种原子最外层电子数之和为18,X与Z同主族,Y原子的最外层电子数等于周期数,W的单质在常温下为气体.下列说法正确的是( )A、原子半径的大小顺序:r(Z)>r(Y)>r(X) B、简单氢化物的稳定性:W>Z C、元素X的单质只存在两种同素异形体 D、X、Y、W最高价氧化物对应的水化物两两之间能发生反应5. 下列指定反应的离子方程式正确的是( )A、向H2O中通入 NO2:3NO2+H2O═H++NO3﹣+2NO B、向Na2SiO3溶液中通入少量SO2:Na2SiO3+SO2+H2O═H2SiO3↓+2Na++SO32﹣ C、用饱和纯減溶液洗涤试管中残留的苯酚:CO32﹣+2 →2
→2  +CO2↑+H2O
D、等体积等物质的量浓度的NH4Fe(SO4)2和Ba(OH)2混合:2Fe3++3SO42﹣+3Ba2++6OH﹣═3BaSO4↓+2Fe(OH)3↓
6. 探究浓硫酸和铜的反应,下列装置或操作正确的是( )A、
+CO2↑+H2O
D、等体积等物质的量浓度的NH4Fe(SO4)2和Ba(OH)2混合:2Fe3++3SO42﹣+3Ba2++6OH﹣═3BaSO4↓+2Fe(OH)3↓
6. 探究浓硫酸和铜的反应,下列装置或操作正确的是( )A、 用装置进行铜和浓硫酸的反应
B、
用装置进行铜和浓硫酸的反应
B、 用装置收集二氧化硫并吸收尾气
C、
用装置收集二氧化硫并吸收尾气
C、 用装置稀释反应后的混合液
D、
用装置稀释反应后的混合液
D、 用装置测定余酸的浓度
7. 下列说法正确的是( )A、MgCO3可以除去MgCl2酸性溶液中的Fe3+ B、实验测得NaHSO3溶液的pH<7,说明则H2SO3是强酸 C、通过化学变化可以“点石成金”,即可将黏土转化成金单质 D、2.24LNO与1.12O2充分反应所得气体中原子数目一定为0.3×6.02×10238. 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
用装置测定余酸的浓度
7. 下列说法正确的是( )A、MgCO3可以除去MgCl2酸性溶液中的Fe3+ B、实验测得NaHSO3溶液的pH<7,说明则H2SO3是强酸 C、通过化学变化可以“点石成金”,即可将黏土转化成金单质 D、2.24LNO与1.12O2充分反应所得气体中原子数目一定为0.3×6.02×10238. 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( ) A、该装置将化学能转化为光能和电能 B、该装置工作时,H+从b极区向a极区迁移 C、每生成1 mol O2 , 有44 g CO2被还原 D、a电极的反应为:3CO2+16H+﹣18e﹣═C3H8O+4H2O9. 给定条件下,下列选项中所示的物质间转化均能通过一步反应实现的是( )A、0.1 mol•L﹣1 HCl Cl2 Ca(ClO)2(aq) B、Al3+ AlO2﹣ Al(OH)3 C、Al NaAlO2(aq) NaAlO2(s) D、MgO(s) Mg(NO3)2(aq) Mg(s)10. 下列关于各图象的解释或得出结论正确的是( )
A、该装置将化学能转化为光能和电能 B、该装置工作时,H+从b极区向a极区迁移 C、每生成1 mol O2 , 有44 g CO2被还原 D、a电极的反应为:3CO2+16H+﹣18e﹣═C3H8O+4H2O9. 给定条件下,下列选项中所示的物质间转化均能通过一步反应实现的是( )A、0.1 mol•L﹣1 HCl Cl2 Ca(ClO)2(aq) B、Al3+ AlO2﹣ Al(OH)3 C、Al NaAlO2(aq) NaAlO2(s) D、MgO(s) Mg(NO3)2(aq) Mg(s)10. 下列关于各图象的解释或得出结论正确的是( ) A、图甲表示0.10mol•L﹣1NaOH溶液滴定20.00 mL 0.10 mol•L﹣1醋酸溶液的滴定曲线 B、图乙表示向乙酸溶液中通入氨气至过量过程中溶液导电性I的变化 C、根据图丙所示可知:石墨转化为金刚石吸收热量,石墨比金刚石稳定 D、图丁表示反应2SO2+O2⇌2SO3 , t1时刻只减小了 SO3的浓度
A、图甲表示0.10mol•L﹣1NaOH溶液滴定20.00 mL 0.10 mol•L﹣1醋酸溶液的滴定曲线 B、图乙表示向乙酸溶液中通入氨气至过量过程中溶液导电性I的变化 C、根据图丙所示可知:石墨转化为金刚石吸收热量,石墨比金刚石稳定 D、图丁表示反应2SO2+O2⇌2SO3 , t1时刻只减小了 SO3的浓度二、不定项选择题
-
11. 某有机物是一种医药中间体.其结构简式如图所示.下列有关该物质的说法正确的是( )
 A、该化合物分子中不含手性碳原子 B、该化合物与NaHCO3溶液作用有CO2气体放出 C、1 mol该化合物与足量溴水反应,消耗2 mol Br2 D、在一定条件下,该化合物与HCHO能发生缩聚反应12. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、使淀粉﹣KI溶液变蓝的溶液:H+、NH4+、Fe2+、Br﹣ B、滴入酚酞呈红色的溶液:Na+、Ca2+、CH3COO﹣、Cl﹣ C、滴入苯酚显紫色的溶液:Mg2+、NH4+、Cl﹣、SCN﹣ D、滴入甲基橙呈红色的溶液:K+、Na+、HCO3﹣、NO3﹣13. 根据下列实验操作和现象所得到的结论正确的是( )
A、该化合物分子中不含手性碳原子 B、该化合物与NaHCO3溶液作用有CO2气体放出 C、1 mol该化合物与足量溴水反应,消耗2 mol Br2 D、在一定条件下,该化合物与HCHO能发生缩聚反应12. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、使淀粉﹣KI溶液变蓝的溶液:H+、NH4+、Fe2+、Br﹣ B、滴入酚酞呈红色的溶液:Na+、Ca2+、CH3COO﹣、Cl﹣ C、滴入苯酚显紫色的溶液:Mg2+、NH4+、Cl﹣、SCN﹣ D、滴入甲基橙呈红色的溶液:K+、Na+、HCO3﹣、NO3﹣13. 根据下列实验操作和现象所得到的结论正确的是( )选项
实验操作和现象
结 论
A
取少量食盐溶于水,加稀硫酸酸化,再滴入淀粉溶液,溶液未呈蓝色
该食盐中不含有碘酸钾
B
将KI和FeCl3溶液在试管中混合后,加入CCl4 , 振荡,静置,下层溶液显紫红色
Fe3+的氧化性大于I2
C
向蛋白质溶液中加入CuCl2或(NH4)2SO4饱和溶液,均有沉淀
蛋白质均发生了变性
D
将0.1mol•L﹣1 , MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol•L﹣1CuSO4溶液,白色沉淀逐渐变为蓝色沉淀
Ksp[Cu(OH)2]<Ksp[Mg(OH)2]
A、A B、B C、C D、D14. 25℃时,用0.0500mol•L﹣1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L﹣1NaOH溶液所得滴定曲线如图.下列说法正确的是( ) A、点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4﹣)=c(OH﹣) B、点②所示溶液中:c(HC2O4﹣)+2c(C2O42﹣)=c(Na+) C、点③所示溶液中:c(Na+)>c(HC2O4﹣)>c(H2C2O4)>c(C2O42﹣) D、滴定过程中可能出现:c(Na+)>c(C2O42﹣)=c(HC2O4﹣)>c(H+)>c(OH﹣)15. 在温度T1和T2时,分别将0.50mol CH4和1.20mol NO2充入体积为1L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
A、点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4﹣)=c(OH﹣) B、点②所示溶液中:c(HC2O4﹣)+2c(C2O42﹣)=c(Na+) C、点③所示溶液中:c(Na+)>c(HC2O4﹣)>c(H2C2O4)>c(C2O42﹣) D、滴定过程中可能出现:c(Na+)>c(C2O42﹣)=c(HC2O4﹣)>c(H+)>c(OH﹣)15. 在温度T1和T2时,分别将0.50mol CH4和1.20mol NO2充入体积为1L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:时间/min
0
10
20
40
50
T1
n(CH4)/mol
0.50
0.35
0.25
0.10
0.10
T2
n(CH4)/mol
0.50
0.30
0.18
…
0.15
下列说法正确的是( )
A、T2时CH4的平衡转化率为70.0% B、该反应的△H>0、T1<T2 C、保持其他条件不变,T1时向平衡体系中再充入0.30 mol CH4和0.80 mol H2O(g),平衡向正反应方向移动 D、保持其他条件不变,T1时向平衡体系中再充入0.50 mol CH4和1.20 mol NO2 , 与原平衡相比,达新平衡时N2的浓度增大、体积分数减小三、非选择题
-
16. 高氯酸是一种酸性极强的无机含氧酸,可用于制备高氯酸盐、人造金刚石提纯等方面.查阅资料得到以下有关高氯酸的信息:
名称
分子式
外观
沸点
高氯酸
HClO4
无色液体
130℃
工业上生产高氯酸的同时还生产了亚氯酸钠,工业流程如图:
 (1)、操作①的名称是 , 操作②的名称是 .(2)、反应器Ⅰ中发生反应的化学方程式为 .(3)、反应器Ⅱ中发生反应的离子方程式为 .(4)、若反应器Ⅱ中SO2以H2O2代替也可达到同样的目,此时发生反应的离子方程式为 .(5)、若想得到201 kg的 HClO4纯品,至少需要NaClO3 kg.(6)、工业上也可用铂作阳极、铜作阴极电解盐酸制得高氯酸,在阳极区可得到20%的高氯酸.写出阳极的电极反应式(其中盐酸与高氯酸以化学式出现) .17. 有机物F是一种治疗关节炎止痛药,合成F的一种传统法路线如图:
(1)、操作①的名称是 , 操作②的名称是 .(2)、反应器Ⅰ中发生反应的化学方程式为 .(3)、反应器Ⅱ中发生反应的离子方程式为 .(4)、若反应器Ⅱ中SO2以H2O2代替也可达到同样的目,此时发生反应的离子方程式为 .(5)、若想得到201 kg的 HClO4纯品,至少需要NaClO3 kg.(6)、工业上也可用铂作阳极、铜作阴极电解盐酸制得高氯酸,在阳极区可得到20%的高氯酸.写出阳极的电极反应式(其中盐酸与高氯酸以化学式出现) .17. 有机物F是一种治疗关节炎止痛药,合成F的一种传统法路线如图: (1)、B中含氧官能团的名称为 .(2)、C→D的反应可分为两步,其反应类型为、 .(3)、写出比F少5个碳原子的同系物X的结构简式:(写一种);X有多种同分异构体,满足下列条件的X的同分异构体共有种.
(1)、B中含氧官能团的名称为 .(2)、C→D的反应可分为两步,其反应类型为、 .(3)、写出比F少5个碳原子的同系物X的结构简式:(写一种);X有多种同分异构体,满足下列条件的X的同分异构体共有种.①属于芳香族化合物 ②苯环上只有1个取代基 ③属于酯类物质
(4)、写出E转化为F和无机盐的化学方程式: .(5)、已知:①
 ②
②  (R、R′表示烃基)
(R、R′表示烃基)合成F的一种改良法是以2﹣甲基﹣1﹣丙醇[(CH3)2CHCH2OH)]、苯、乙酸酐[(CH3CO)2O]为原料来合成,写出有关的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
H2C=CH2 CH3CH2Br CH3CH2OH.
18. 水中的溶解氧的含量是衡量水质的一个重要指标,某实验兴趣小组通过如下步骤来测量水中溶解氧的含量:步骤一:向溶解氧测量瓶中注入20.00mL水样,再分别加入1mL 0.1mol•L﹣1MnSO4溶液和3mL NaOH和KI的混合溶液,充分反应.此时发生反应的化学方程式为:Mn2++2OH﹣═Mn(OH)2↓ 2Mn(OH)2+O2═2MnO(OH)2
步骤二:向上述混合物中加入1.5mL浓硫酸,充分反应后制沉淀完全溶解,此时溶液呈黄色.
步骤三:将溶液全部转移到容量瓶中,向其中滴加2〜3滴淀粉溶液,溶液呈蓝色.用 0.005mol•L﹣1的Na2S2O3标准溶液滴定至蓝色恰好消失,共消耗Na2S2O3标准溶液3.60mL.此时发生反应为:I2+2Na2S2O3═2NaI+Na2S4O6
(1)、25℃时,步骤一中当加入NaOH使溶液的pH=12时,此时溶液中的c(Mn2+)=mol•L﹣1 . (已知 KspMn(OH)2=2.06×10﹣13)(2)、写出步骤二中所发生反应的化学方程式:(3)、计算该水样中溶解氧的含量.(单位:mg•L﹣1 , 请写出计算过程)19. 三氯化铁是合成草酸铁的重要原料.(1)、利用工业FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)3•5H2O]的实验流程如图所示:
①为抑制FeCl3水解,溶液X为 .
②上述流程中FeCl3能被异丙醚萃取,其原因是;检验萃取、分液后所得水层中是否含有Fe3+的方法是 .
③所得Fe2(C2O4)3•5H2O需用冰水洗涤,其目的是 .
④为测定所得草酸铁晶体的纯度,实验室称取a g样品,加硫酸酸化,用KMnO4标准溶液滴定生成的H2C2O4 , KMnO4标准溶液应置于右图所示仪器(填“甲”或“乙”)中.下列情况会造成实验测得Fe2(C2O4)3•5H2O含量偏低的是 .
a.盛放KMnO4的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
(2)、某研究性学习小组欲从蚀刻镀铜电路板所得废液(溶质为FeCl2、CuCl2、FeCl3)出发,制备单质铜和无水FeCl3 , 再由FeCl3合成Fe2(C2O4)3•5H2O.请补充完整由蚀刻废液制备单质铜和无水FeCl3的实验步骤(可选用的试剂:铁粉、盐酸、NaOH溶液和H2O2溶液):向废液中加入足量铁粉,充分反应后过滤;;调节溶液pH,将溶液蒸发浓缩、冷却结晶、过滤、洗涤干燥得FeCl3•6H2O; , 得到无水FeCl3 . 20. 甲醇是一种重要的可再生能源.(1)、已知:2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=a kJ/mol
20. 甲醇是一种重要的可再生能源.(1)、已知:2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=a kJ/molCO(g)+2H2(g)=CH3OH(g)△H=b kJ/mol
写出由CH4和O2制取CH3OH(g)的热化学方程式: .
(2)、反应:CO(g)+2H2(g)═CH3OH(g)的平衡常数K的表达式为;图1是反应时CO和CH3OH(g)的物质的量浓度随时间(t)的变化曲线.从反应开始至达到平衡时,用H2表示的反应速率v(H2)= .
(3)、在一容积可变的密闭容器中充入10mol CO和20mol H2 , 发生反应并达到平衡,CO的平衡转化率随温度(T)、压强(P)的变化曲线如图2所示.①能判断该反应达到化学平衡状态的是(填选项字母).
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.H2的转化率和CO的转化率相等
D.混合气体的平均相对分子质量不再改变
②比较A、B两点压强大小:P(A) P(B)(填“>”、“<”或“=”).
③比较KA、KB、KC的大小:
(4)、以甲醇为燃料,O2为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极).若KOH溶液足量,写出燃料电池负极的电极反应式: .
四、【化学-选修题3:物质结构与性质】
-
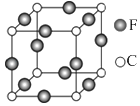
21. A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大.元素A是原子半径最小的元素;B元素基态原子的核外电子分占四个原子轨道(能级);D元素原子的已成对电子总数是未成对电子总数的3倍;E与D处于同一主族;F位于ds区,且原子的最外层只有1个电子.(1)、F+离子的电子排布式是 .(2)、B、C、D元素的第一电离能由大到小的顺序是 .(3)、B、C元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物的化学式是;B、C的这些氢化物的沸点相差较大的主要原因是 .(4)、A、B、D可形成分子式为A2BD的某化合物,则该化合物分子中B原子的轨道杂化类型是;1mol该分子中含有π键的数目是 .(5)、C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 , C原子的配位数是 .
五、【化学-选修题5:实验化学】
-
22. 苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯.


制备苯甲酸苯酯的实验步骤为:
步骤1:将20mL浓H2SO4与40mL冰醋酸在下图装置的烧杯中控制在5℃以下混合.
步骤2:向烧杯中继续加入过硫酸钾25g,用电磁搅拌器搅拌4~5分钟,将二苯甲酮9.1g溶于三氯甲烷后,加到上述混合液中,控制温度不超过15℃,此时液体呈黄色.
步骤3:向黄色液体中加水,直至液体黄色消失,但加水量一般不超过1mL,室温搅拌5h.
步骤4:将反应后的混合液倒入冰水中,析出苯甲酸苯酯,抽滤产品,用无水乙醇洗涤,干燥
(1)、步骤1中控制在5℃以下混合的原因为 .(2)、步骤2中为控制温度不超过15℃,向混合液中加入二苯甲酮的三氯甲烷溶液的方法是 .(3)、步骤3中加水不超过1mL,原因是 .(4)、步骤4中抽滤用到的漏斗名称为 .(5)、整个制备过程中液体混合物会出现褐色固体,原因是;除去该固体操作为 .
-