2017年北京市门头沟区高考化学模拟试卷(3月份)
试卷更新日期:2017-05-15 类型:高考模拟
一、选择题
-
1. 根据所给的信息和标志,判断下列说法不正确的是( )
A
B
C
D

《神农本草经》记载,麻黄能“止咳逆上气”

84消毒液主要成分是NaClO

易拉罐主要成分是金属铝

贴有该标志的物品是可回收物
古代中国人已用麻黄治疗咳嗽
用于杀菌消毒和衣物的洗涤漂白
不可以用氢氧化钠溶液将其溶解
废纸、塑料、玻璃、金属均可回收
A、A B、B C、C D、D2. 下列解释事实的方程式不正确的是( )A、硫酸型酸雨的形成涉及反应:2H2SO3+O2 2H2SO4 B、SO2的水溶液显酸性:SO2+H2O⇌H2SO3⇌2H++SO32﹣ C、常温下,0.1mol/L醋酸溶液pH≈3:CH3COOH⇌CH3COO﹣+H+ D、Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)⇌Mg2+(aq)+2OH﹣(aq),该固体可溶于NH4Cl溶液3. 依据图中氮元素及其化合物的转化关系,判断下列说法不正确的是( )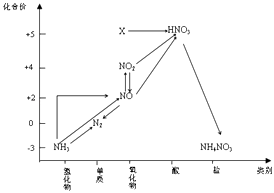 A、X是N2O5 B、可用排空气法收集NO气体 C、工业上以NH3、空气、水为原料生产硝酸 D、由NH3→N2 , 从原理上看,NH3可与NO2反应实现4. 下列说法不正确的是( )A、酿酒过程中,葡萄糖可通过水解反应生成酒精 B、丙烷和2﹣甲基丙烷的一氯代物均为两种 C、油脂发生皂化反应能生成甘油 D、
A、X是N2O5 B、可用排空气法收集NO气体 C、工业上以NH3、空气、水为原料生产硝酸 D、由NH3→N2 , 从原理上看,NH3可与NO2反应实现4. 下列说法不正确的是( )A、酿酒过程中,葡萄糖可通过水解反应生成酒精 B、丙烷和2﹣甲基丙烷的一氯代物均为两种 C、油脂发生皂化反应能生成甘油 D、 是高分子化合物
是高分子化合物  的单体
5. 下列说法正确的是( )
的单体
5. 下列说法正确的是( )A
B
C
D
钢闸门容易被腐蚀
a、b均为惰性电极,b极反应是:O+4OH﹣﹣4e﹣=2H2O
阴、阳两极生成的气体的物质的量之比是1:1
电池工作一段时间
后,乙池溶液的总质量增加



 A、A B、B C、C D、D6. 下列气体的制备和性质实验中,由现象得出的结论正确的是( )
A、A B、B C、C D、D6. 下列气体的制备和性质实验中,由现象得出的结论正确的是( )选项
操作
现象
结论
A
向二氧化锰固体中加入浓盐酸后加热,将产生的气体通入淀粉碘化钾溶液液
溶液变蓝
Cl2具有氧化性
B
向亚硫酸钠固体中加入浓硫酸,将产生的气体通入溴水
溴水褪色
SO2具漂白性
C
向蔗糖溶液中加稀硫酸,水浴加热后,加入新制氢氧化铜,加热
溶液变蓝
蔗糖水解产物没有还原性
D
无水乙醇与浓硫酸共热170℃,将产生的气体通入酸性高锰酸钾溶液
溶液褪色
乙烯可被化酸性高锰酸钾氧化
A、A B、B C、C D、D7. 羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害.在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)⇌COS(g)+H2(g),K=0.1,反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是( )A、升高温度,H2S浓度增加,表明该反应的△H>0 B、随着反应的进行,混合气体的密度逐渐减小 C、反应前H2S物质的量为7mol D、CO的平衡转化率为80%二、解答题
-
8. 我国成功研制出具有自主知识产权的治疗急性缺血性脑卒中的一类化学新药﹣丁苯酞(J),标志着我国在脑血管疾病治疗药物研究领域达到了国际先进水平.合成丁苯酞的一种路线如图所示.

已知:①

②C能发生银镜反应;
③J是一种酯,分子中除苯环外还含有一个五元环
回答下列问题:
(1)、由A生成B的化学方程式为 , 其反应类型为(2)、C结构简式为(3)、下列说法正确的是A、C能发生加成反应、聚合反应 B、D存在顺反异构 C、D的核磁共振氢谱有两个峰,且峰面积比为3:1(4)、J的结构简式为 , H在一定条件下还能生成高分子化合物K,H生成K的化学方程式为(5)、写出两种符合下列条件的G的同分异构体的结构简式①核磁共振氢谱有4组峰 ②能与FeCl3溶液发生显色反应
(6)、参考题中信息和所学知识,写出由乙烯和化合物A合成邻甲基苯乙烯( )的路线流程图(其他试剂任选) 9. “一带一路”将为中国化工企业开辟新的国际市场,其中,能源、资源整合和环境治理是保驾护航的基础.(1)、下面是不同过程的热化学方程式,请写出FeO(s)被CO还原成Fe和CO2的热化学方程式
)的路线流程图(其他试剂任选) 9. “一带一路”将为中国化工企业开辟新的国际市场,其中,能源、资源整合和环境治理是保驾护航的基础.(1)、下面是不同过程的热化学方程式,请写出FeO(s)被CO还原成Fe和CO2的热化学方程式已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H1=﹣25kJ•mol﹣1①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H2=﹣47kJ•mol﹣1②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H3=+19kJ•mol﹣1③
(2)、贵金属的冶炼中往往会产生有毒气体,先进技术使用NaBH4为诱导剂,可使Co2+与肼(N2H4)在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体.①写出该反应的离子方程式: .
②在纳米钴的催化作用下,肼可以发生分解反应3N2H4(g) N2(g)+4NH3(g)
保持温度不变,向容积固定的容器中充入一定量的肼,下列描述能够说明体系处于平衡状态的是
a.容器内压强不随时间改变
b.单位时间内生成amol N2的同时,生成4molNH3
c.N2H4和NH3的物质的量之比保持不变的状态
d.混合气体的平均摩尔质量保持不变的状态
若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图1所示,其中曲线b表示的是(物质的化学式)的体积分数随温度的变化情况,为抑制肼的分解,可采取的合理措施有(任写一种).
 (3)、大气污染气的主要成分是SO2和NO2 . 利用图2所示装置(电极均为惰性电极)可以吸收SO2 , 还可以用阴极排出的溶液吸收NO2 .
(3)、大气污染气的主要成分是SO2和NO2 . 利用图2所示装置(电极均为惰性电极)可以吸收SO2 , 还可以用阴极排出的溶液吸收NO2 .①a极为(填“阴”“阳”) b极的电极反应式为 .
②简述该装置能吸收SO2的原理: .
10. 黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.(1)、冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2若CuFeS2中Fe的化合价为+2,反应中被还原的元素是(填元素符号).(2)、冶炼铜的主要流程如图1:
①气体A中的大气污染物可选用下列试剂中的吸收.
a.浓H2SO4 b.稀HNO3 c.NaOH溶液
②用稀HNO3浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,一位同学由此得出该熔渣中铁元素价态为+3的结论.请指出该结论是否合理并说明理由
(3)、冶炼出的铜可以发生下列反应(图2)①写出Cu溶于稀H2SO4和H2O2混合液的离子方程式: .
②写出Cl2将Z氧化为K2EO4的化学方程式: .
③对于0.1mol•L﹣1 CuSO4溶液,正确的是 .
A、常温下,pH>7
B、c(Cu2+)>c(SO42﹣)>c(H+)>c(OH﹣)
C、c(H+)+2c(Cu2+)=2c(SO42﹣)+c(OH﹣)
11. 以Al和不同的铜盐溶液间的反应为实验对象,探索Al与不同铜盐溶液反应的多样性.实验
向试管中加入2mL溶液
实验现象

实验Ⅰ:0.5mol/LCuCl2溶液
15s:大量气泡且有红色物质析出
60s:反应进一步加快且反应剧烈放热,液体几乎沸腾
120s:铝片反应完,试管中析出大量蓬松的红色物质
实验Ⅱ:0.5mol/LCuSO4溶液
15s 无明显现象
60s:铝片表面有极少气泡
120s:有少量气泡溢出,铝片边缘有很少红色物质生成
(1)、对实验Ⅰ进行研究②④①实验Ⅰ中生成红色物质的离子方程式为:
②经检验实验Ⅰ中产生的气体为氢气,用离子方程式解释溶液中存在H+的原因:
③请写出60s后反应进一步加快可能的原因(写出两条)
(2)、对实验Ⅱ进行研究实验Ⅱ反应明显比实验Ⅰ缓慢,说明Al与不同的铜盐溶液反应呈现多样性,其原因可能有:
假设一:SO42﹣对Al与Cu2+的置换反应存在一定的抑制作用.
假设二:
(3)、为进一步研究上述假设,设计如下实验:实验
向试管中加入2mL溶液
实验现象

实验Ⅲ:0.5mol/LCuCl2溶液+1g Na2SO4固体
加入 Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾
实验Ⅳ:0.5mol/L CuCl2溶液+5g Na2SO4固体
加入Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾
实验Ⅴ:0.5mol/LCuSO4溶液+0.02mol NaCl固体
未加入 NaCl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全
实验Ⅵ:0.5mol/LCuSO4溶液+NH4Cl固体
未加入 NH4Cl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全
实验Ⅵ的设计目的是:
其中,实验Ⅰ与实验Ⅲ、Ⅳ做对比,结论为:
其中,实验Ⅱ与实验Ⅴ、Ⅵ做对比,结论为:
(4)、请设计实验证明Cl﹣对Al与H+的反应同样起到相似的作用: