浙江省台州市2018-2019学年八年级下学期科学教学质量检测(二)
试卷更新日期:2019-04-29 类型:月考试卷
一、选择题(本题有 15 小题,每小题 2 分,共 30 分)
-
1. 如图所示,一条形磁铁周围放着能自由转动的小磁针甲、乙、丙、丁,这四根磁针静止时 N 极指向画错的是(磁针的黑端表示 N 极)( )
 A、磁针甲 B、磁针乙 C、磁针丙 D、磁针丁2. 汽车安全气囊内所装的化学物质,能在碰撞后 10ms 内,生成一种空气中含量最多的气体,该气体是( )A、氧气 B、二氧化碳 C、稀有气体 D、氮气3. 下列符号中,既表示一个原子,又表示一种元素,还能表示一种物质的是( )A、C60 B、O C、Fe D、2H4. 如图所示,小磁针在纸面内能自由转动。则开关闭合后,下列判断正确的是( )
A、磁针甲 B、磁针乙 C、磁针丙 D、磁针丁2. 汽车安全气囊内所装的化学物质,能在碰撞后 10ms 内,生成一种空气中含量最多的气体,该气体是( )A、氧气 B、二氧化碳 C、稀有气体 D、氮气3. 下列符号中,既表示一个原子,又表示一种元素,还能表示一种物质的是( )A、C60 B、O C、Fe D、2H4. 如图所示,小磁针在纸面内能自由转动。则开关闭合后,下列判断正确的是( ) A、通电螺线管下端为 N 极 B、小磁针将沿顺时针方向转动 C、在通电螺线管中插入铜棒后磁性增强 D、当滑动变阻器的滑片向 b 移动时,螺旋管的磁场减弱5. 如图所示实验操作中正确的是( )A、氧气的验满
A、通电螺线管下端为 N 极 B、小磁针将沿顺时针方向转动 C、在通电螺线管中插入铜棒后磁性增强 D、当滑动变阻器的滑片向 b 移动时,螺旋管的磁场减弱5. 如图所示实验操作中正确的是( )A、氧气的验满 B、过滤
B、过滤  C、给液体加热
C、给液体加热  D、铁丝在氧气中燃烧
D、铁丝在氧气中燃烧  6. 1999 年诺贝尔奖获得者艾哈迈德·泽维尔,开创了“飞秒化学” 的新领域,他发明的激光光谱技术,使观测化学反应时分子中原子的运动成为可能。你认为该技术不能观测到的是( )A、 化学变化中反应物分子的分解 B、反应中原子的运动 C、化学变化中反应物分子的形成 D、原子核的内部结构7. 小明在一块有机玻璃板上安装了一个用导线绕成的螺线管,在板面上均匀撒满铁屑。通电后轻敲玻璃板,铁屑的排列如图所示。下列说法正确的是( )
6. 1999 年诺贝尔奖获得者艾哈迈德·泽维尔,开创了“飞秒化学” 的新领域,他发明的激光光谱技术,使观测化学反应时分子中原子的运动成为可能。你认为该技术不能观测到的是( )A、 化学变化中反应物分子的分解 B、反应中原子的运动 C、化学变化中反应物分子的形成 D、原子核的内部结构7. 小明在一块有机玻璃板上安装了一个用导线绕成的螺线管,在板面上均匀撒满铁屑。通电后轻敲玻璃板,铁屑的排列如图所示。下列说法正确的是( ) A、在实验中不可以用铜屑代替铁屑显示磁场分布 B、图中 A、B两点相比, B点处的磁场较强 C、若将电源的正负极对调,闭合开关,轻敲玻璃板,铁屑的分布情况改变 D、若只增大螺线管中的电流, A、 B两点处的磁场方向会发生改变8. 知识梳理有助于我们对已学知识的巩固,如图是某同学学习完第二章后以氧气为例进行的梳理,下列选项中与 a、 b、 c、 d 相对应的是( )
A、在实验中不可以用铜屑代替铁屑显示磁场分布 B、图中 A、B两点相比, B点处的磁场较强 C、若将电源的正负极对调,闭合开关,轻敲玻璃板,铁屑的分布情况改变 D、若只增大螺线管中的电流, A、 B两点处的磁场方向会发生改变8. 知识梳理有助于我们对已学知识的巩固,如图是某同学学习完第二章后以氧气为例进行的梳理,下列选项中与 a、 b、 c、 d 相对应的是( ) A、原子、原子核、分子、核外电子 B、原子、分子、原子核、核外电子 C、分子、原子、核外电子、原子核 D、分子、原子、原子核、核外电子9. 燃着的小木条在空气中用力甩一下能熄灭,其原因是( )A、清除了可燃物 B、隔绝了氧气 C、小木条的着火点升高 D、温度降到小木条的着火点以下10. 当空气受 SO2 严重污染时,可通过飞机喷洒 X 粉末,使空气中的 SO2 含量明显降低,该过程发生的反应是 2X+2SO2+O2═2CaSO4+2CO2 , 则 X 的化学式是( )A、CaO B、Na2CO3 C、Ca(OH)2 D、CaCO311. 2016 年 IUPAC 命名 117 号元素为 Ts(中文名“
A、原子、原子核、分子、核外电子 B、原子、分子、原子核、核外电子 C、分子、原子、核外电子、原子核 D、分子、原子、原子核、核外电子9. 燃着的小木条在空气中用力甩一下能熄灭,其原因是( )A、清除了可燃物 B、隔绝了氧气 C、小木条的着火点升高 D、温度降到小木条的着火点以下10. 当空气受 SO2 严重污染时,可通过飞机喷洒 X 粉末,使空气中的 SO2 含量明显降低,该过程发生的反应是 2X+2SO2+O2═2CaSO4+2CO2 , 则 X 的化学式是( )A、CaO B、Na2CO3 C、Ca(OH)2 D、CaCO311. 2016 年 IUPAC 命名 117 号元素为 Ts(中文名“ ” , tián), Ts 的原子核外最外层电子数是 7,下列说法不正确的是( ) A、 Ts的相对原子质量是117 B、Ts在化学该反应中能得到 1 个电子 C、Ts是非金属元素 D、Ts的质子数为 11712. 市场上支持无线充电的智能手机和充电器(如图甲所示)大部分都符合“Qi” 规格。“Qi”源自汉语“气功” 中的“气” 。 Qi 技术的原理如图乙:在发射端和接收端各有一个线圈,电流流过发射线圈会产生变化的磁场,当接收线圈靠近该变化的磁场时就会产生电流给手机充电。则接收线圈的原理相当于( )
” , tián), Ts 的原子核外最外层电子数是 7,下列说法不正确的是( ) A、 Ts的相对原子质量是117 B、Ts在化学该反应中能得到 1 个电子 C、Ts是非金属元素 D、Ts的质子数为 11712. 市场上支持无线充电的智能手机和充电器(如图甲所示)大部分都符合“Qi” 规格。“Qi”源自汉语“气功” 中的“气” 。 Qi 技术的原理如图乙:在发射端和接收端各有一个线圈,电流流过发射线圈会产生变化的磁场,当接收线圈靠近该变化的磁场时就会产生电流给手机充电。则接收线圈的原理相当于( ) A、
A、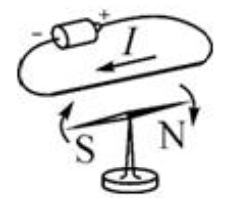 B、
B、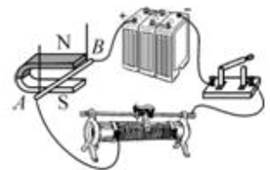 C、
C、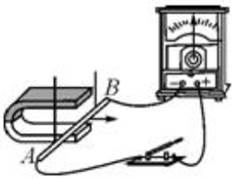 D、
D、 13. 在一定条件下,将四种物质放入密闭容器内充分反应,测得反应前后各物质的质量如下:
13. 在一定条件下,将四种物质放入密闭容器内充分反应,测得反应前后各物质的质量如下:物质
甲
乙
丙
丁
反应前质量/g
1
27
4
8
反应后质量/g
10.6
2.5
待测
8
下列说法正确的是( )
A、该反应属于分解反应 B、反应后丙物质的质量为 14.9g C、丁物质一定是该反应的催化剂 D、乙的质量一定等于甲和丙的质量之和14. 如图所示的家庭电路中,闭合开关后发现灯泡不亮。用测电笔检测 A 点、 B 点,氖管都发光;用测电笔检测插座的两个孔,发现氖管也都能发光。发生这一现象的原因可能是( ) A、灯泡断路 B、灯泡短路 C、进户零线断路 D、进户火线断路15. 在化学反应 A2+BC=B+A2C 中,反应物 BC 与生成物B的质量关系如图所示。将 2gA2与 80gBC 恰好完全反应,则生成 A2C 的质量为( )
A、灯泡断路 B、灯泡短路 C、进户零线断路 D、进户火线断路15. 在化学反应 A2+BC=B+A2C 中,反应物 BC 与生成物B的质量关系如图所示。将 2gA2与 80gBC 恰好完全反应,则生成 A2C 的质量为( ) A、64g B、18g C、80g D、9g
A、64g B、18g C、80g D、9g二、填空题(本题有7小题,20空格,每空1分,共20分)
-
16. 地壳中含量最多的金属元素是 , 含最多的非金属元素是 , 由这两种元素组成的化合物的化学式为。17. 在原子内部,核外电子绕原子核运动会形成环形电流,环形电流产生的磁场使原子的两侧相当于两个磁极。如图所示,若纸外表示 N 极,则电子绕原子核运动的方向为(选填“顺时针” 或“逆时针” )方向。
 18. 如图是某一变化过程的微观示意图,请根据图回答下列问题:
18. 如图是某一变化过程的微观示意图,请根据图回答下列问题: (1)、请写出上述化学反应的方程式。(2)、化学变化前后一定不变的是( )(填序号)。
(1)、请写出上述化学反应的方程式。(2)、化学变化前后一定不变的是( )(填序号)。A.元素种类 B.原子种类 C.分子数目 D.原子数目。
(3)、 和
和  的化学性质不同的原因是。 19. 如图甲所示的两种使用测电笔的方法,错误的是 。如图乙所示,用电水壶烧水时,若水加的太满,则沸腾时水会溢出,可能导致电路 , 使空气开关跳闸。
的化学性质不同的原因是。 19. 如图甲所示的两种使用测电笔的方法,错误的是 。如图乙所示,用电水壶烧水时,若水加的太满,则沸腾时水会溢出,可能导致电路 , 使空气开关跳闸。 20. 如图是实验室利用高锰酸钾制取氧气的装置图,试回答下列问题:
20. 如图是实验室利用高锰酸钾制取氧气的装置图,试回答下列问题: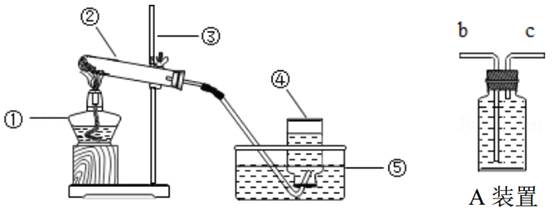 (1)、写出装置中标有序号的仪器的名称: ③ , ④(2)、请你指出该实验装置的一个错误:。(3)、高锰酸钾制取氧气时有如下操作步骤: ①加热; ②检查装置的气密性; ③装药品;④用排水法收集氧气; ⑤从水槽中取出导管; ⑥熄灭酒精灯; ⑦连接装置。其操作顺序正确的是
(1)、写出装置中标有序号的仪器的名称: ③ , ④(2)、请你指出该实验装置的一个错误:。(3)、高锰酸钾制取氧气时有如下操作步骤: ①加热; ②检查装置的气密性; ③装药品;④用排水法收集氧气; ⑤从水槽中取出导管; ⑥熄灭酒精灯; ⑦连接装置。其操作顺序正确的是A.⑦②③①④⑤⑥ B.①⑦③②⑤④⑥ C.⑤⑦③②①④⑥ D.⑦③①②④⑥⑤
(4)、若用A装置收集该气体,则气体应从端进入(填“c”或“b”)。21. 在反应A+3B=2C+3D中,已知2.3gA跟4.8gB恰好完全反应生成4.4gC。已知D的相对分子质量为18,则A的相对分子质量为。22. 在“质量守恒定律“的课堂教学中,老师引导同学们进行“化学反应中,反应物与生成物的质量关系” 的实验探究。同学们按如图所示的实验装置和选用药品进行了规范的操作、准确的称量和细致的观察。
 (1)、A实验:白磷刚引燃,立即将锥形瓶放到天平上称量,天平不平衡。结论一:质量不守恒;待锥形瓶冷却后,重新放到托盘天平上称量,天平平衡。结论二:质量守恒。你认为哪个结论是正确的。而导致另一种结论错误的原因是。(2)、B、C实验中发生了相同的化学反应(2HCl+Na2CO3=2NaCl+H2O+CO2↑),但化学反应结束后称量,发现 B 实验中天平指针指向(填“偏左”或“偏右”)。而C实验中天平仍然平衡,分析其原因是。(3)、D组同学完成镁带燃烧实验后发现镁带质量增加了,你认为镁带燃烧符合“质量守恒定律”吗?。
(1)、A实验:白磷刚引燃,立即将锥形瓶放到天平上称量,天平不平衡。结论一:质量不守恒;待锥形瓶冷却后,重新放到托盘天平上称量,天平平衡。结论二:质量守恒。你认为哪个结论是正确的。而导致另一种结论错误的原因是。(2)、B、C实验中发生了相同的化学反应(2HCl+Na2CO3=2NaCl+H2O+CO2↑),但化学反应结束后称量,发现 B 实验中天平指针指向(填“偏左”或“偏右”)。而C实验中天平仍然平衡,分析其原因是。(3)、D组同学完成镁带燃烧实验后发现镁带质量增加了,你认为镁带燃烧符合“质量守恒定律”吗?。三、实验探究题(本题有3小题,15空格,每空格2分,共 30 分)
-
23. 小华在探究电磁现象的实验中,设计了如图所示的实验装置。
 (1)、①在图甲中将磁体向右插入螺线管中时,观察到灵敏电流计的指针向右偏转,由此可知:电路中有产生。
(1)、①在图甲中将磁体向右插入螺线管中时,观察到灵敏电流计的指针向右偏转,由此可知:电路中有产生。②将磁体从螺线管中向左拔出时,会观察到灵敏电流计的指针向(选填“左”或“右” )偏转。
③通过前两步实验,可得出感应电流的方向与的方向有关.
(2)、图乙装置的实验结果表明磁场对通电导体;为了使实验效果更明显,图中悬挂在细线下的金属棒最好选用(填字母代号)A.铁棒 B.玻璃棒 C.铝棒 D.铜棒
24. 研究表明,许多金属氧化物对氯酸钾分解有催化作用,分别用下列金属氧化物作催化剂,氯酸钾开始发生分解反应和反应剧烈时的温度如表所示:温度/℃
Fe2O3
Al2O3
CuO
MgO
开始反应
470
515
305
49
剧烈反应
490
540
350
545
(1)、上述实验中,从温度对反应催化效果来看,最好选用作催化剂.(2)、加热氢氧化铜固体可制得氧化铜和一种常见液体物质,写出该反应的化学方程式。探究:氧化铜与二氧化锰的催化效果哪一个更好?
用如图装置进行实验,实验均以生成 25mL 气体为准,可能影响实验的其他因素均以忽略,记录实验数据如下表:

序号
KClO3 质量
催化剂质量
待测数据
①
2.45g
﹣
a
②
2.45g
0.51gMnO2
b
③
2.45g
0.51gCuO
c
(3)、实验①的作用;上述实验中的“待测数据” 处应填。若 bc,(填“>”、“=”或“<”)可知在某温度下氧化铜对氯酸钾分解效果更好。25. 某兴趣小组的同学在利用图 1 进行“测空气中氧气的体积分数” 的实验:
⑴请你写出红磷燃烧时的化学反应方程式:⑵实验时打开止水夹,水能进入广口瓶的原因是
⑶实验结束时小组同学发现用该方法测出的氧气含量远低于 21%。
【提出问题】这是为什么?
【进行猜想】
①装置漏气; ②; ③…
在老师的指导下,小组同学在装置气密性能良好、操作规范的情况下,重复图 1 实验,测定结果还是低于 20%,用测氧气浓度的传感器测得反应后装置内氧气浓度为 8.85%。
⑷【查阅资料】:燃烧过程中当氧气体积分数低于 7%时,红磷就无法继续燃烧,因此通过上述实验,测量结果与理论值误差较大。
【实验探究】再次测定空气中氧气含量。
该小组同学根据铁在空气中生锈的原理设计图 2 实验装置。
同学们采用了“暖宝宝” 做实验,暖宝宝中含有铁粉、活性炭、水、氯化钠等物质。装置中饱和食盐水会加速铁生锈。 18 分钟后测得的实验数据如下表。根据如表数据计算,改进实验后测得的空气中氧气的体积分数是。(写出数据表达式即可)
测量项目 实验前 实验后 量筒中水的体积 量筒中剩余水的体积 集气瓶(扣除内容物)和导管的容积 体积/mL 100.0 74.5 126.0 【结论】该测定方法,装置内残留的氧气更少,实验结果更准确。
四、解答题(本题有3小题,第26题8分,第27题5分,第28题7分,共20分)
-
26. 1989 年世界卫生组织把铝列为食品污染源之一,每人每日的摄入量控制在 0.004g 以下。若在 1kg 米面食品中加入明矾 2g(明矾的化学式为 KAl(SO4)2·12H2O),请回答下列问题:(1)、人从食物中摄入的铝指的是( )(填字母)。
A.铝元素 B.铝单质 C.铝合金
(2)、明矾中 K∶S∶H 的质量比= ;铝元素的质量分数为(计算结果精确到0.1%)。(3)、如果某人一天吃了 100g 上述面食品,通过计算说明其摄入的铝的量是否超过安全摄入量?(通过计算说明)27. 某学习小组在实验室中用加热 KClO3 和 MnO2 混合物的方法制取 O2 , 反应过程中固体质量变化如图所示(混合固体干燥) , 请计算。 (1)、生成的 O2 质量是g.(2)、原混合物中 KClO3 的质量分数?(写出计算过程,计算结果精确到 0.1%)28. 工业上用电解氧化铝的方法制取单质铝的化学通电方程式为: ,电解 10t 氧化铝最多可生产多少吨铝?小丽和小明两位同学分别采用了如图两种不同的计算方法。
(1)、生成的 O2 质量是g.(2)、原混合物中 KClO3 的质量分数?(写出计算过程,计算结果精确到 0.1%)28. 工业上用电解氧化铝的方法制取单质铝的化学通电方程式为: ,电解 10t 氧化铝最多可生产多少吨铝?小丽和小明两位同学分别采用了如图两种不同的计算方法。
请你回答下列问题:
(1)、你认为他们的解题思路和方法都正确吗?(2)、对“34g 过氧化氢完全分解产生氧气的质量为多少克? ”一题,你认为也能用上述两种方法解答吗?试试看,请把能用的解法过程写出来。(3)、你认为在什么情况下,小丽和小明同学的解法都能使用?