2016年广东省深圳市高考化学一模试卷
试卷更新日期:2017-05-15 类型:高考模拟
一、选择题
-
1. 《新修本草》是我国古代中药学著作之一,记载药物844种,其中有关于“青矾”的描述为:“本来绿色,新出窟未见风者,正如瑠璃…烧之赤色…”据此推测,“青矾”的主要成分为( )
A、CuSO4•5H2O B、FeSO4•7H2O C、KAl(SO4)2•12H2O D、Fe2(SO4)3•9H2O2. NA为阿伏加德罗常数的值,下列叙述正确的是( )A、20 g D2O所含的电子数为10 NA B、25℃时,pH=13的Ba(OH)2溶液中含有的OH﹣数目为0.1 NA C、1 mo1 Na被氧化成Na2O2 , 失去电子数目为2 NA D、氢气与氯气反应生成标准状况下22.4 L氯化氢,断裂化学键总数为2 NA3. 分子中苯环上的一个氢被﹣C4H9原子团取代形成的有机物共有( ) A、9种 B、10种 C、12种 D、15种4. 下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
分子中苯环上的一个氢被﹣C4H9原子团取代形成的有机物共有( ) A、9种 B、10种 C、12种 D、15种4. 下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )实验
现象
结论
A
将氯气通入品红溶液
溶液红色褪去
氯气具有漂白性
B
将铜粉加入1.0mol•L﹣1
的Fe2(SO4)3溶液中
溶液变蓝,有黑色固体出现
金属Fe比Cu活泼
C
用坩埚钳夹住用砂纸仔细打磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点比较低
D
向盛有少量浓硝酸、稀硝酸的两支试管中分别加入一片大小相同的铜片
浓硝酸中铜片很快开始溶解,并放出红棕色气体;稀硝酸中过一会铜片表面才出现无色气体,气体遇空气变红棕色
浓硝酸氧化性强于稀硝酸
A、A B、B C、C D、D5. 某兴趣小组设计了如图所示原电池装置(盐桥中吸附有饱和K2SO4溶液).下列说法正确的是( )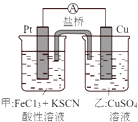 A、该原电池的正极反应是Cu2++2e﹣=Cu B、甲烧杯中溶液的血红色逐渐变浅 C、盐桥中的SO42﹣流向甲烧杯 D、若将甲烧杯中的溶液换成稀硝酸,电流表指针反向偏转6. W、X、Y、Z是原子序数依次增大的短周期主族元素.W的气态氢化物的水溶液显碱性,X和Y同主族,Y元素的最高化合价为最低化合价的绝对值的3倍.下列说法错误的是( )A、阴离子的还原性:Y>X B、Y和Z的简单阴离子都会破坏水的电离平衡 C、最高价氧化物的水化物的酸性:Z>Y D、氢化物的热稳定性:W>X7. 常温下,浓度均为0.1mol∙L﹣1、体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg 随加入NaOH的物质的量的变化如图所示.下列叙述正确的是( )
A、该原电池的正极反应是Cu2++2e﹣=Cu B、甲烧杯中溶液的血红色逐渐变浅 C、盐桥中的SO42﹣流向甲烧杯 D、若将甲烧杯中的溶液换成稀硝酸,电流表指针反向偏转6. W、X、Y、Z是原子序数依次增大的短周期主族元素.W的气态氢化物的水溶液显碱性,X和Y同主族,Y元素的最高化合价为最低化合价的绝对值的3倍.下列说法错误的是( )A、阴离子的还原性:Y>X B、Y和Z的简单阴离子都会破坏水的电离平衡 C、最高价氧化物的水化物的酸性:Z>Y D、氢化物的热稳定性:W>X7. 常温下,浓度均为0.1mol∙L﹣1、体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg 随加入NaOH的物质的量的变化如图所示.下列叙述正确的是( ) A、HX的酸性弱于HY B、a点由水电离出的c(H+)=10﹣12 mol∙L﹣1 C、c点溶液中:c(Y﹣)>c(HY) D、b点时酸碱恰好完全反应
A、HX的酸性弱于HY B、a点由水电离出的c(H+)=10﹣12 mol∙L﹣1 C、c点溶液中:c(Y﹣)>c(HY) D、b点时酸碱恰好完全反应二、解答题
-
8. 某学习小组开展下列突验探究活动
 (1)、装置A中反应的化学方程式为(2)、设计实验:利用装置1中产生的气体证明+4价硫具有氧化性(3)、选用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱
(1)、装置A中反应的化学方程式为(2)、设计实验:利用装置1中产生的气体证明+4价硫具有氧化性(3)、选用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱
装置连接顺序为A,C, , , D,F,其中装置C的作用是 , 通过现象即可证明亚硫酸的酸性强于次氯酸
(4)、利用G装置可测定装置A残液中SO2的含量,量取1.00mL残夜于烧瓶中,加适量的水稀释,加热使SO2全部溢出并与锥形瓶中H2O2完全反应SO2+H2O2=H2SO4然后用0.1000mol/L﹣1NaOH标准溶液进行滴定,至终点时消耗NaOH溶液20.00mL.①图G中球形冷凝管进水口为(填“a”或“b”)
②残液中SO2含量为 g.L﹣1
③经过多次测定发现,测定值始终高于实际值,则其原因是 .
 9. 高锰酸钾是一种常用的氧化剂.下图是利用软锰矿(主要成分为MnO2)制备高锰酸钾的一种工艺(流程中部分产物已略去):
9. 高锰酸钾是一种常用的氧化剂.下图是利用软锰矿(主要成分为MnO2)制备高锰酸钾的一种工艺(流程中部分产物已略去):
相关物质不同温度下的溶解度(单位:g)数据如表:
物质
温度
KMnO4
CH3COOK
K2SO4
KCl
20℃
6.34
217
11.1
34.2
90℃
45.2
398
22.9
53.9
(1)、“熔融”步骤反应的化学方程式为 .(2)、K2MnO4溶液中加入冰醋酸发生反应的离子方程式为: .(3)、操作2是、、 .(4)、图中可以直接进行循环利用的物质是(填化学式) .(5)、KMnO4粗晶体中的主要杂质(填化学式)有和 , 若用硫酸代替图中的冰醋酸,则导致的问题及原因是 .10. 氮及其化合物在生产生活中有广泛应用.(1)、已知:CO可将部分氮的氧化物还原为N2 .反应Ⅰ:2CO(g)+2NO(g)⇌N2(g)+2CO2(g)△H=﹣746kJ•mol﹣1
反应Ⅱ:4CO(g)+2NO2(g)⇌N2(g)+4CO2(g)△H=﹣1200kJ•mol﹣1
写出CO将NO2还原为NO的热化学方程式 .
(2)、在密闭容器中充入5mol CO和4mol NO,发生上述反应I,图1为平衡时NO的体积分数与温度、压强的关系.
回答下列问题:
①温度:T1T2(填“<”或“>”).
②某温度下,在体积为2L的密闭容器中,反应进行10分钟放出热量373kJ,用CO的浓度变化表示的平均反应速率v(CO)= .
③某温度下,反应达到平衡状态D点时,容器体积为2L,此时的平衡常数K=(结果精确到0.01);若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的点
(3)、某温度时,亚硝酸银AgNO2的 Ksp=9.0×10﹣4、Ag2SO4的Ksp=4.0×10﹣5 , 当向含NO2﹣、SO42﹣混合溶液中加入AgNO3溶液至SO42﹣恰好完全沉淀(即SO42﹣浓度等于1.0×10﹣5 mol•L﹣1)时,c(NO2﹣)= .(4)、如图2,在酸性条件下,电解水中CN﹣可转化为CO2和N2 , 请写出阳极的电极反应式 .11. 锗是重要的半导体材料,应用于航空航天测控、光纤通讯等领域.一种提纯二氧化锗粗品(主要含GeO2、As2O3)的工艺如下:
已知:①“碱浸”过程中的反应为:
GeO2+2NaOH═Na2GeO3+H2O
As2O3+2NaOH═2NaAsO2+H2O
②“蒸馏”过程中的反应为:Na2GeO3+6HCl═2NaCl+GeCl4+3H2O
③GeCl4的熔点为﹣49.5℃,AsCl3与GeCl4的沸点分别为130.2℃、84℃.
(1)、锗的原子序数为32,锗在元素周期表中的位置为第周期族.(2)、“氧化除砷”的过程是将NaAsO2氧化为Na3AsO4 , 其反应方程式为: .(3)、传统的提纯方法是将粗品直接加入盐酸中蒸馏,其缺点是 .(4)、工业上与蒸馏操作相关的设备有A、蒸馏釜 B、离心萃取机 C、冷凝塔 D、加压过滤机(5)、“水解”操作时发生的化学反应方程式为 , “水解”操作时保持较低温度有利于提高产率,其最可能的原因是(答一条即可).(6)、若1吨二氧化锗粗品(含杂质30%)经提纯得0.745吨的高纯二氧化锗产品,则杂质脱除率为 .三、[化学-选修3:物质结构与性质]
-
12. 张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用.氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途.回答下列问题:
 (1)、As原子的核外电子排布式为 .(2)、P和S是同一周期的两种元素,P的第一电离能比S大,原因是 .(3)、NH4+中H﹣N﹣H的键角比NH3中H﹣N﹣H的键角(填“大”或“小”),原因是 .(4)、Na3AsO4中含有的化学键类型包括;AsO43﹣的空间构型为 , As4O6的分子结构如图1所示,则在该化合物中As的杂化方式是 .(5)、化合物NH5中的所有原子最外层都满足稳定结构,则NH5是晶体.(6)、白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小圆圈表示白磷分子).已知晶胞的边长为a cm,阿伏加德罗常数为NA mol﹣l , 则该晶胞中含有的P原子的个数为 , 该晶体的密度为 g•cm﹣3(用含NA、a的式子表示).
(1)、As原子的核外电子排布式为 .(2)、P和S是同一周期的两种元素,P的第一电离能比S大,原因是 .(3)、NH4+中H﹣N﹣H的键角比NH3中H﹣N﹣H的键角(填“大”或“小”),原因是 .(4)、Na3AsO4中含有的化学键类型包括;AsO43﹣的空间构型为 , As4O6的分子结构如图1所示,则在该化合物中As的杂化方式是 .(5)、化合物NH5中的所有原子最外层都满足稳定结构,则NH5是晶体.(6)、白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小圆圈表示白磷分子).已知晶胞的边长为a cm,阿伏加德罗常数为NA mol﹣l , 则该晶胞中含有的P原子的个数为 , 该晶体的密度为 g•cm﹣3(用含NA、a的式子表示).四、[化学-选修5:有机化学基础]
-
13. A(C2H4)是基本的有机化工原料.用A和常见的有机物可合成一种醚类香料和一种缩醛类香料.具体合成路线如图所示(部分反应条件略去):

已知以下信息:
①

②D为单取代芳香族化合物且能与金属钠反应;每个D分子中只含有1个氧原子,D中氧元素的质量分数约为13.1%.
回答下列问题:
(1)、A的名称是 , 图中缩醛的分子式是 .(2)、B的结构简式为 , C中含有的官能团名称是 .(3)、⑥的反应类型是 .(4)、⑤的化学方程式为 .(5)、请写出满足下列条件的苯乙醛的所有同分异构体的结构简式:含有苯环和 结构,核磁共振氢谱有4组峰,峰面积之比为3:2:2:1. (6)、参照
结构,核磁共振氢谱有4组峰,峰面积之比为3:2:2:1. (6)、参照 的合成路线,设计一条由2﹣氯丙烷和必要的无机试剂制备
的合成路线,设计一条由2﹣氯丙烷和必要的无机试剂制备  的合成路线(注明必要的反应条件).
的合成路线(注明必要的反应条件).
-