上海市普陀区2018-2019学年高考化学二模考试试卷
试卷更新日期:2019-04-24 类型:高考模拟
一、单选题
-
1. 下列文物的材质属于合金的是( )A、新石器彩陶缸 B、商代青铜四羊方尊 C、战国水晶杯 D、西汉素纱衣2. 可用于治疗甲状腺疾病,其同位素原子可能( )A、质子数为78,中子数为53 B、质子数为54,中子数为131 C、质子数为53,质量数为127 D、质子数为78,质量数为1313. 对核外电子运动状态的描述,较为全面的是( )A、结构示意图 B、电子式 C、电子排布式 D、轨道表达式4. 对Cl2的叙述正确的是( )A、能用钢瓶贮存 B、与过量的Fe反应只生成FeCl2 C、与H2混合光照可制取HCl D、与澄清石灰水反应制取漂粉精5. 对
 认识正确的是( ) A、名称为3-甲基丁烷 B、所有碳原子在同一平面上 C、难溶于水 D、不能发生分解、加成、消去反应6. 分别装在体积相同容器中的乙烯和丙烯,一定具有相同的( )A、质量 B、分子数 C、碳碳双键数 D、含碳量7. HCl气体难分解是因为( )A、HCl相对分子质量大 B、HCl分子极性强 C、H—Cl键键能大 D、H—Cl键极性强8. 比较合成氨工业与制硫酸中SO2催化氧化的生产过程,正确的是( )A、都按化学方程式中的系数比投料 B、都选择了较大的压强 C、使用不同的催化剂加快反应速率 D、都采用吸收剂分离产物9. 将浓度均为0.1mol∙L-1的下列溶液稀释10倍,其中pH增大的是( )A、HNO3 B、NaOH C、KI D、NaHCO310. 不影响滴定结果准确性的操作是( )A、滴定前,用水洗净的滴定管装标准液 B、滴定前,用待测液润洗锥形瓶 C、滴定时,用少量蒸馏水冲洗锥形瓶内壁 D、滴定时,停止振荡锥形瓶11. 不能通过一步反应实现的是( )A、H2S SO2 B、S SO3 C、SO2 H2SO4 D、H2SO4(浓) SO212. 与H2反应生成
认识正确的是( ) A、名称为3-甲基丁烷 B、所有碳原子在同一平面上 C、难溶于水 D、不能发生分解、加成、消去反应6. 分别装在体积相同容器中的乙烯和丙烯,一定具有相同的( )A、质量 B、分子数 C、碳碳双键数 D、含碳量7. HCl气体难分解是因为( )A、HCl相对分子质量大 B、HCl分子极性强 C、H—Cl键键能大 D、H—Cl键极性强8. 比较合成氨工业与制硫酸中SO2催化氧化的生产过程,正确的是( )A、都按化学方程式中的系数比投料 B、都选择了较大的压强 C、使用不同的催化剂加快反应速率 D、都采用吸收剂分离产物9. 将浓度均为0.1mol∙L-1的下列溶液稀释10倍,其中pH增大的是( )A、HNO3 B、NaOH C、KI D、NaHCO310. 不影响滴定结果准确性的操作是( )A、滴定前,用水洗净的滴定管装标准液 B、滴定前,用待测液润洗锥形瓶 C、滴定时,用少量蒸馏水冲洗锥形瓶内壁 D、滴定时,停止振荡锥形瓶11. 不能通过一步反应实现的是( )A、H2S SO2 B、S SO3 C、SO2 H2SO4 D、H2SO4(浓) SO212. 与H2反应生成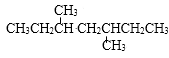 的单炔烃有( ) A、1种 B、2种 C、4种 D、8种13. 用绿矾(FeSO4∙7H2O)配制FeSO4溶液, 常加入稀硫酸和( )A、锌粉 B、铁粉 C、硫酸铁 D、盐酸14. 下列物质间不能发生化学反应的是( )A、AgCl固体和KI溶液 B、Na2SO4固体和浓盐酸 C、CH3COONa固体和浓盐酸 D、NaHCO3固体和石灰水15. 分析图,甲、乙具有的共性是( )
的单炔烃有( ) A、1种 B、2种 C、4种 D、8种13. 用绿矾(FeSO4∙7H2O)配制FeSO4溶液, 常加入稀硫酸和( )A、锌粉 B、铁粉 C、硫酸铁 D、盐酸14. 下列物质间不能发生化学反应的是( )A、AgCl固体和KI溶液 B、Na2SO4固体和浓盐酸 C、CH3COONa固体和浓盐酸 D、NaHCO3固体和石灰水15. 分析图,甲、乙具有的共性是( ) A、反应物能量均高于生成物能量 B、电极反应均有Fe-2e-→Fe2+ C、碳棒上均发生氧化反应 D、溶液pH均增大16. 下列事实中,能说明醋酸是弱酸的是( )A、冰醋酸能和氨水反应 B、冰醋酸加水后导电性增强 C、醋酸溶液能溶解CaCO3 D、醋酸溶液加热后c(CH3COO-)变大17. 已知:2H2(g)+O2(g)→2H2O (g)+ 483.6 kJ,2H2(g)+O2(g)→2H2O (l)+ 571.6 kJ;图中示意正确的是( )A、
A、反应物能量均高于生成物能量 B、电极反应均有Fe-2e-→Fe2+ C、碳棒上均发生氧化反应 D、溶液pH均增大16. 下列事实中,能说明醋酸是弱酸的是( )A、冰醋酸能和氨水反应 B、冰醋酸加水后导电性增强 C、醋酸溶液能溶解CaCO3 D、醋酸溶液加热后c(CH3COO-)变大17. 已知:2H2(g)+O2(g)→2H2O (g)+ 483.6 kJ,2H2(g)+O2(g)→2H2O (l)+ 571.6 kJ;图中示意正确的是( )A、 B、
B、 C、
C、 D、
D、 18. 实验室制取乙酸丁酯,装置图中正确的是( )A、
18. 实验室制取乙酸丁酯,装置图中正确的是( )A、 B、
B、 C、
C、 D、
D、 19. 为达成下列实验目的,所用方法正确的是( )
19. 为达成下列实验目的,所用方法正确的是( )实验目的
实验方法
A.
证明海带提碘实验中有碘生成
浸出液中加入足量氯水再加入少量淀粉溶液
B.
检验FeSO4溶液是否完全变质
试样中滴酸性KMnO4溶液
C.
实验室制取溴苯
光照苯和液溴的混合物
D.
除去乙烷中的乙烯气体
催化加热条件下与H2反应
A、A B、B C、C D、D二、综合题
-
20. 聚合氯化铝晶体([Al2(OH)nCl(6-n)•XH2O]m)是一种高效无机水处理剂。它的制备原理是调节AlCl3溶液的pH,通过促进其水解而结晶析出。
回答下列问题:
(1)、铝原子核外能量最高的电子有个。分析AlCl3熔点较低的原因(熔点:AlCl3—194℃,Al2O3—2054℃,NaCl—801℃)。(2)、比较聚合氯化铝晶体中同周期两种元素的原子半径,并用原子结构知识说明理由。(3)、铝灰(主要成分为Al、Al2O3 , 另有少量CuO、SiO2、FeO和Fe2O3杂质)可制备AlCl3 , 如果先除去铝灰中的金属氧化物杂质可选用(选填:“强碱”或“强酸”)。写出其中Al发生反应的离子方程式。(4)、制备聚合氯化铝晶体,需严格控制溶液的pH在4.0~4.5才能使产率达到最大。结合AlCl3水解的离子方程式,用化学平衡移动原理解释控制pH在4.0~4.5之间的原因21. 净化汽车尾气对于保护环境意义重大。其中的一个反应原理为:2NO(g)+2CO(g) N2(g)+2CO2(g)+Q(Q>0)。回答下列问题:
(1)、一定温度下,将等物质的量的NO和CO通入固定容积为4L的密闭容器中,反应过程中部分物质的物质的量变化如图所示,则0~20min平均反应速率v(NO)为。 (2)、如图所示,若Y表示平衡常数,只改变某一反应条件X,反应由平衡I达到新平衡Ⅱ,则条件X为 , NO的转化率为平衡I平衡Ⅱ(填:“大于”、“小于”或“不变”)
(2)、如图所示,若Y表示平衡常数,只改变某一反应条件X,反应由平衡I达到新平衡Ⅱ,则条件X为 , NO的转化率为平衡I平衡Ⅱ(填:“大于”、“小于”或“不变”) (3)、能判断该反应达到平衡状态的标志是(选填编号)
(3)、能判断该反应达到平衡状态的标志是(选填编号)a.v生成(CO2)=v消耗(CO)
b.混合气体的平均相对分子质量不再改变
c.平衡常数保持不变
d.NO、CO、N2、CO2的浓度均不再变化
(4)、在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态。请在下图中,补充画出从t2到t4时刻正反应速率随时间的变化曲线 。 (5)、三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2 , 其反应分两步进行。第一步是:C3N3(OH)3 3HCNO;第二步是HCNO与NO2反应,把氮元素和碳元素转变成无毒气体。请写出第二步发生的化学反应方程式 , 每消除1mol NO2转移电子个。22. 聚乳酸E在服装、卫生医疗制品等行业具有广泛的应用。某有机化合物A在一定条件下通过一系列反应可合成E;同时还可得到C和D等重要有机化合物。转化关系如下图:
(5)、三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2 , 其反应分两步进行。第一步是:C3N3(OH)3 3HCNO;第二步是HCNO与NO2反应,把氮元素和碳元素转变成无毒气体。请写出第二步发生的化学反应方程式 , 每消除1mol NO2转移电子个。22. 聚乳酸E在服装、卫生医疗制品等行业具有广泛的应用。某有机化合物A在一定条件下通过一系列反应可合成E;同时还可得到C和D等重要有机化合物。转化关系如下图:
完成下列填空:
(1)、B→E反应类型: , D→G实验室中反应条件:。(2)、A的分子式:。(3)、与F同类别的同分异构体还有HCOOCH(CH3)2 、HCOOCH2CH2CH3和(用结构简式表示)。(4)、写出实验室中判断D中有G生成的方法;(5)、石油产品丙烯及必要的无机试剂可合成丙烯酸,设计合成路线如下:CH3CH=CH2 ClCH2CH=CH2→甲→乙→丙
ClCH2CH=CH2→甲→乙→丙  丙烯酸。
丙烯酸。 已知:
i.

请完成合成路线中的:ClCH2CH=CH2→甲→乙→丙。
三、实验题
-
23. 1942年,我国化工专家侯德榜以NaCl、NH3、CO2等为原料制得纯碱,他的“侯氏制碱法”为世界制碱工业做出了突出贡献。
回答下列问题:
某探究活动小组欲在实验室中模拟制取纯碱,设计了Ⅰ、Ⅱ两种方案,并选择其一进行实验。
方案Ⅰ:(1)将足量CO2通入饱和NaCl溶液中;(2)再在所得溶液中通入足量NH3;(3)过滤;……。
方案Ⅱ:(1)将足量NH3通入饱和NaCl溶液中;(2)再在所得溶液中通入足量CO2;(3)过滤;……。
(1)、部分实验装置如图所示。制取氨气的装置应选用(选填编号)。 (2)、写出实验中获得碳酸氢钠的离子方程式(3)、灼烧碳酸氢钠需要(选填编号)。
(2)、写出实验中获得碳酸氢钠的离子方程式(3)、灼烧碳酸氢钠需要(选填编号)。a.蒸发皿 b.坩埚 c.烧杯 d.烧瓶 e.酒精灯
(4)、选择的实验方案是(选填“Ⅰ”或“Ⅱ”),说明选择的理由(5)、甲同学取少量产品完全溶于水,滴加稀硝酸2-3滴,再滴加硝酸银溶液,观察到有白色沉淀生成,得出纯碱含杂质Cl-的结论。乙同学认为甲的结论不一定正确,你认为乙同学的理由是。(6)、按下列流程处理母液(提取完碳酸氢钠后的滤液)可得到NH4Cl。
通入NH3的作用是(选填编号)。操作a是 , 操作b是。
a.增大NH4+浓度,使NaHCO3更多地析出
b.增大NH4+浓度,使NH4Cl更多地析出
c.使NaHCO3转化为溶解度更大的Na2CO3 , 提高析出的NH4Cl纯度