2011年四川省绵阳市中考化学试卷
试卷更新日期:2017-05-12 类型:中考真卷
一、选择题
-
1. 生活中的下列做法利用了化学反应原理的是( )A、自制简易净水器净化自来水 B、门锁不易打开时灌入铅笔芯粉末 C、用天然气作燃料煮饭 D、用活性炭除去冰箱中的异味2. 阳刚同学按教材中的家庭小实验自制汽水,可是家里没有冰箱,为了使自制的汽水变得冰凉可口,他想到可以从集镇上购买一种商品来产生制冷效果,他应该买的是( )A、硝酸铵 B、生石灰 C、食盐 D、氯化钠3. 瘦肉精是一类对人体健康危害极大的化学物质,政府已严禁在猪饲料中添加瘦肉精.常见的瘦肉精化学式为C12H18OCl2N2 , 下列有关这种瘦肉精的说法中正确的是( )A、是一种无机化合物 B、分子中碳、氢、氧三种元素的质量比为72:9:8 C、相对分子质量为277g D、由C12H18O、Cl2、N2三种分子组成4. 人们常在可燃物建筑材料中添加阻燃剂以防止火灾,Mg(OH)2是一种常见的阻燃剂,在380℃时分解成水蒸气和耐高温的MgO,并吸收大量的热.下列说法错误的是( )A、Mg(OH)2分解吸热能降低可燃物的着火点 B、Mg(OH)2分解吸热能降低可燃物的温度 C、Mg(OH)2分解的产物能使可燃物与氧气隔绝 D、MgCO3比CaCO3易分解,也可作阻燃剂5. 如图是甲、乙、丙三种物质的溶解度曲线,下面说法不正确的是( )
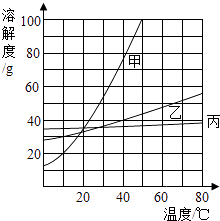 A、甲的溶解度受温度影响最大 B、10℃时,三种物质的溶解度大小顺序为:丙>乙>甲 C、30℃时,乙、丙两种物质的饱和溶液溶质质量分数相等 D、50℃时,分别将40g甲、乙两种物质放入100g水中充分搅拌,均得到饱和溶液6. 下列实验操作不符合规范的是( )A、点燃可燃性气体之前检验气体的纯度 B、蒸发滤液时用玻璃棒不断搅拌滤液 C、通过口尝来确定实验室中某种试剂的味道 D、用酒精灯加热试管里的固体时先预热7. 为除去下列物质中的杂质(括号内为杂质),下列操作方法不能达到目的是( )
A、甲的溶解度受温度影响最大 B、10℃时,三种物质的溶解度大小顺序为:丙>乙>甲 C、30℃时,乙、丙两种物质的饱和溶液溶质质量分数相等 D、50℃时,分别将40g甲、乙两种物质放入100g水中充分搅拌,均得到饱和溶液6. 下列实验操作不符合规范的是( )A、点燃可燃性气体之前检验气体的纯度 B、蒸发滤液时用玻璃棒不断搅拌滤液 C、通过口尝来确定实验室中某种试剂的味道 D、用酒精灯加热试管里的固体时先预热7. 为除去下列物质中的杂质(括号内为杂质),下列操作方法不能达到目的是( )选项
物质(杂质)
操作方式
A
Cu(Fe)
加足量稀硫酸,充分反应后过滤
B
CO(O2)
缓慢通过灼热铜网
C
NaCl溶液(Na2CO3)
加盐酸至恰好不再产生气泡为止
D
FeSO4溶液(CuSO4)
加入足量铁屑,充分反应后过滤
A、A B、B C、C D、D8. 镍氢充电电池有着广泛应用,镍及其化合物能发生下列反应:①Ni+2HCl=NiCl2+H2↑ ②NiO+2HCl=NiCl2+H2O ③NiO2+4HCl=NiCl2+Cl2↑+2H2O
对上述反应的分析判断错误的是( )
A、镍能与氯化铜溶液发生置换反应 B、NiCl2能与NaOH溶液发生复分解反应 C、反应②和③都是复分解反应 D、反应中Ni①、③的化合价都发生了变化9. 相同质量的Mg、Fe分别与稀盐酸作用,产生H2的质量m(H2)与加入稀盐酸的体积V(稀盐酸)关系如下图所示,其中正确的是( )A、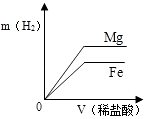 B、
B、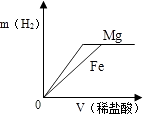 C、
C、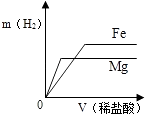 D、
D、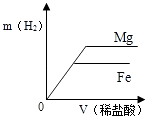
二、填空题
-
10. 如图是一种家用电热水壶,所用材料属于合金的是(填字母序号,下同),属于单质的是 , 属于合成材料的是 .
 11. 学习化学需要在宏观物质的性质与其微观结构之间建立联系.1个CO2分子由 构成.在氢氧化钠、氯化钠、硫酸三种物质中,由阴阳离子构成的是 , 常温下,这三种物质的水溶液中pH<7的是 .12. A~G七种物质之间具有如下图所示的转化关系.已知:A是一种含铁的矿石的主要成分,其中金属与非金属元素的原子个数比为1:2;B中铁的质量分数为70%,C是有刺激性气味的无色气体,它是形成酸雨的物质之一;F可溶于G的稀溶液并产生气体,该气体是有利于环境保护的理想燃料.请回答下列问题:
11. 学习化学需要在宏观物质的性质与其微观结构之间建立联系.1个CO2分子由 构成.在氢氧化钠、氯化钠、硫酸三种物质中,由阴阳离子构成的是 , 常温下,这三种物质的水溶液中pH<7的是 .12. A~G七种物质之间具有如下图所示的转化关系.已知:A是一种含铁的矿石的主要成分,其中金属与非金属元素的原子个数比为1:2;B中铁的质量分数为70%,C是有刺激性气味的无色气体,它是形成酸雨的物质之一;F可溶于G的稀溶液并产生气体,该气体是有利于环境保护的理想燃料.请回答下列问题: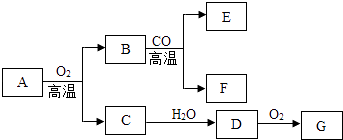
①A的化学式为 , 已知A转化为B时金属元素的化合价升高,则A中非金属元素的化合价是
②B与CO反应的化学方程式是 .
③C→D反应的化学方程式是 .
④B与G的稀溶液反应的化学方程式是
13.实验室给你提供了下列仪器,请选用合适的仪器完成指定的实验
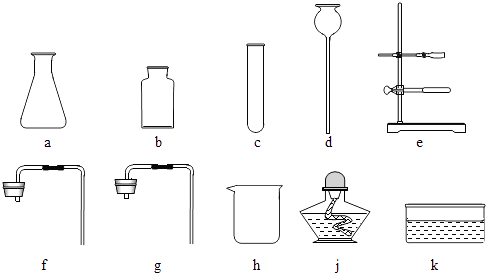 (1)、①要制取较多的O2用来探究其性质(要求制取过程中可以添加反应物),组装气体发生装置需要的仪器是(填序号),收集氧气应采用法.
(1)、①要制取较多的O2用来探究其性质(要求制取过程中可以添加反应物),组装气体发生装置需要的仪器是(填序号),收集氧气应采用法.②提纯初盐时,过滤需要选用上述仪器中的(填序号),出此之外还缺少的仪器是滤纸、、(填名称).
(2)、美羊羊同学的购物袋装薯片中发现还有一个小袋,上面标有“成分:CaO、Fe;作用:防潮、防氧化;警告:禁止食用”等字样,撕开小袋,发现里面的固体粉末有少许是棕红色,大多数是灰白色的.经过分析,她认为棕红色粉末是Fe2O3 , 灰白色粉末应该含有CaCO3和Fe,为验证自己的判断,美羊羊同学打算进行实验探究,请你一同参与.
【实验目的】证实灰白色粉末中含有CaCO3和Fe.
【实验设计】装置如图所示:

【实验预测与分析】
①若要证实样品中含有CaCO3 , 观察到的实验现象是 ,B中发生反应的化学方程式为 .
②若要证实样品中含有Fe,E中应该观察到的现象是 ,此时C装置的作用是
③看了美羊羊同学的分析结论,有同学认为小袋内灰白色粉末中还应该有别的物质,请你写出其中一种物质的化学式 .
三、解答题
-
14. 我市有丰富的石灰石资源,为了测定某地石灰石中碳酸钙的质量分数,取7.5g样品放入烧杯,加入稀盐酸至恰好不再产生气体时消耗34.7g,放出的气体在常温下体积为1.1L.(1)、常温下CO2气体的密度为2.0g/L,则上述反应放出气体的质量为 g.(2)、如石灰石中的杂质均不溶于水且不与盐酸反应,计算石灰石中CaCO3的质量分数和反应所得溶液中溶质的质量分数(计算最终结果保留1位小数).