安微省黄山市2018-2019学年高考理综-化学二模考试试卷
试卷更新日期:2019-04-23 类型:高考模拟
一、选择题;本题共13个小题,每小题6分。
-
1. 化学与生活密切相关,下列说法错误的是( )A、电子垃圾统一回收、拆解、再利用,能够减少对土壤和水源的污染 B、可溶性的铝盐和铁盐可用作生活用水的净水剂 C、油脂、糖类以及蛋白质在人体内均能发生水解反应 D、硫酸钙和碳酸钙都可作建筑材料2. NA代表阿伏加德罗常数的值。下列说法正确的是( )A、H2S的燃烧热是QkJ/mol,充分燃烧H2S,当有0.5QJ热量放出时,转移的电子数为6NA B、25℃时,500mLpH=11的碳酸钠溶液中,由水电离出的OH-数目为0.0005NA C、pH=2的H3PO4溶液中,H+的数目为0.01NA D、0.10L2.0mol·L-1的NalHCO3溶液中HC 和C 的离子数之和为0.2NA3. 下列对有机物的描述正确的是( )A、组成为C6H14的烷烃中仅能由1种单缺烃加氢而制得的结构有2种 B、立方烷
 燃烧的现象与乙烷燃烧的现象相同
C、
燃烧的现象与乙烷燃烧的现象相同
C、 分子中所有原子不可能处于同一平面
D、用碳酸钠溶液不能一次性鉴别乙酸、苯和乙醇三种无色液体
4. 由下列实验及现象能推出相应结论的是( )
分子中所有原子不可能处于同一平面
D、用碳酸钠溶液不能一次性鉴别乙酸、苯和乙醇三种无色液体
4. 由下列实验及现象能推出相应结论的是( )实验
现象
结论
A
某溶液中滴加K3[Fe(CN)6]溶液
产生蓝色沉淀
原溶液中有Fe2+ , 没有Fe3+
B
将红热的木炭投入浓硫酸中产生的气体通入澄清的石灰水
石灰水变浑浊
木炭化成CO2
C
加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸
石蕊试纸变蓝
NH4HCO3显碱性
D
将0.1mol/L的NaCl溶液滴入硝酸银溶液至不现有沉淀产生,再滴加0.1mol/L KI溶液
先有白色沉淀生成,后变黄色沉淀
Ksp(AgCl) >Ksp(AgI)
A、A B、B C、C D、D5. 短周期元素X、Y、Z、W原子序数依次增加,其中只有Z为金属元素,X、W为同一主族元素。X元素原子的L层电子是K层的两倍;点燃条件下,Z的单质在X与Y形成的最高价化合物甲中能发生反应生成化合物乙和X的单质。下列判断错误的是( )
A、W的单质可做半导体材料 B、Z可能位于元素周期表第三周期ⅡA族 C、4种元素的原子中,Y原子的半径最小 D、工业上通过电解化合物乙来制取乙的单质6. 天然气的主要成分为CH4 , 可将CH4设计成燃料电池,来解决能源问题,装置如图所示。在标准状况下,持续通入甲烷,消耗甲烷VL。下列说法错误的是( )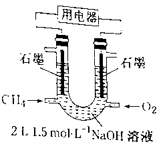 A、当0<V≤33.6L时,负极反应式为 B、正极反应式为 C、当V=67.2L时,电池总反应方程式可写为CH4+2O2+NaOH=NalCO3+2H2O D、电解质溶液中的Na+向正极移动7. 在某温度时,将nmol·L-1氨水滴入10mL1.0mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是( )
A、当0<V≤33.6L时,负极反应式为 B、正极反应式为 C、当V=67.2L时,电池总反应方程式可写为CH4+2O2+NaOH=NalCO3+2H2O D、电解质溶液中的Na+向正极移动7. 在某温度时,将nmol·L-1氨水滴入10mL1.0mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是( )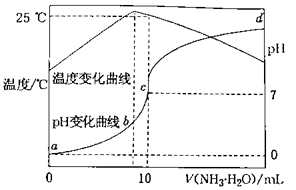 A、a点Kw=1.0×10-14 B、b点:c( )>c(Cl-)>c(H+)>c(OH-) C、25℃时,NH4Cl水解常数为(n-1)×10-7(用n表示) D、d点水的电离程度最大
A、a点Kw=1.0×10-14 B、b点:c( )>c(Cl-)>c(H+)>c(OH-) C、25℃时,NH4Cl水解常数为(n-1)×10-7(用n表示) D、d点水的电离程度最大二、非选择题
-
8. 亚硝酰氯(ClNO)是有机物合成中的重要试剂,可由NO与Cl2在常温常压下反应得到。ClNO 部分性质如下:黄色气体,熔点:-59.6℃,沸点:-6.4℃,遇水易水解。已如:HNO2既有氧化性又有还原性: AgNO2微溶于水,能溶于硝酸:AgNO2+HNO3=AgNO3+HNO2。
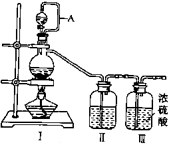 (1)、利用Ⅰ、Ⅱ、Ⅲ装置制备原料气NO和Cl2
(1)、利用Ⅰ、Ⅱ、Ⅲ装置制备原料气NO和Cl2①写出利用装置Ⅰ制备氯气的离子反应方程式:。
② 利用上述装置制备NO时,Ⅱ中盛装物质为(写化学式)。
(2)、利用以下装置在常温常压下制备ClNO
①装置连接顺序为a→按气流自左向右方向,用小写字母表示)。
②为使NO和Cl2恰好完全反应生成CNO,理论上通入NO和Cl2 , 两种气体的流速比为。
③装置Ⅸ的作用是。
④装置吸收尾气,有同学认为尾气中的某种气体不能完金被吸收。为了充分吸收尾气,可将尾气与(气体)同时通入NaON溶液中。
⑤王水是浓盐酸和浓硝酸的混酸,一定条件下混酸可生成ClNO和Cl2 , 该反应的化学方程式为。
⑥写出验证ClNO与H2O完全反应后的溶液中存在Cl-和HNO2的实验步骤:取少量反应后的溶液于试管中,。(限选试剂如下:AgNO3溶液,稀硝酸,KMnO4溶液)
9. Zn、Fe及其化合物在生产生活中应用比较广泛。工业上利用锌培砂(主要含ZnO、ZnFe2O4还含有少量FeO和CuO等杂质)制取金属锌的工艺流程如下: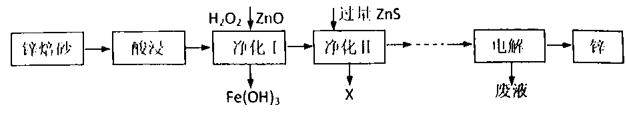 (1)、为了提高酸浸效率,可采用的措施有(任答两条):写出ZnFe2O4溶于酸的离子方程式(2)、向净化Ⅰ操作中加入ZnO的目的(3)、若净化后的溶液中Cu2+浓度为1×10-12mol/L,则净化后溶液中Zn2+浓度为(已知:室温下KSp(ZnS)=1.6×10-24 , Ksp(CuS)=6.4×10-36)(4)、“电解”工艺制锌时Zn2+利用率较低,废液中有大量的Zn2+残留。某化工厂拟采用改变酸锌比净化废液的方式来提高原料的利用率,降低成本。下图是工业生产中不同酸锌比时净化液利用率对电解时直流电耗能影响关系图。根据下图分析,该工厂净化废液时的最佳酸锌比为 。
(1)、为了提高酸浸效率,可采用的措施有(任答两条):写出ZnFe2O4溶于酸的离子方程式(2)、向净化Ⅰ操作中加入ZnO的目的(3)、若净化后的溶液中Cu2+浓度为1×10-12mol/L,则净化后溶液中Zn2+浓度为(已知:室温下KSp(ZnS)=1.6×10-24 , Ksp(CuS)=6.4×10-36)(4)、“电解”工艺制锌时Zn2+利用率较低,废液中有大量的Zn2+残留。某化工厂拟采用改变酸锌比净化废液的方式来提高原料的利用率,降低成本。下图是工业生产中不同酸锌比时净化液利用率对电解时直流电耗能影响关系图。根据下图分析,该工厂净化废液时的最佳酸锌比为 。 A、5:1 B、6:1 C、7:1 D、10:1(5)、ZnFe2O4是一种性能优良的软磁材料,工业上常利用ZnFe(C2O4)3·6H2O隔绝空气加热分解制备,该晶体的热分解化学方程式为。测热分解后产品中ZnFe2O4的质量分数方法如下:取a克产品用H2SO4溶解后加入足量Kl溶液充分反应,调溶液至弱酸性,再加入淀粉指示剂,用cmol/LNa2S2O3标准溶渡滴定,用去此标准溶液vml时,刚好到达滴定终点,则此产品中ZnFe2O4的质量分数为(用a、c、v表示)。(已知:l2+2S2O32-=2l-+S4O62-)10. 深入研究碳元素的化合物有重要意义,回答下列问题:(1)、在恒温、恒容密闭容器中加入H2C2O4 , 发生反应:H2C2O4(s) CO2(g)+CO(g)+H2O(g),下列全叙述能说明反应已经达到平衡状态的是 。A、压强不再变化 B、CO2(g)的体积分数保持不变 C、混合气体的密度不再变化 D、混合气体的平均(2)、工业上可以通过CO(g)+2H2(g) CH3OH(g)制造甲醇在一容积可变容器中充入2molCO和4molH2 , CO的平衡转化率随温度(T)、压强(P)的变化关系如图所示,该反应的△H0(填“>”、“<”或”=”) ,比较A点时用CO表示的正反应速率与B点时用CH3OH表示的逆反应速率的大小V正(CO)V逆(CH3OH)(填”>”、”<”或“=”)。
A、5:1 B、6:1 C、7:1 D、10:1(5)、ZnFe2O4是一种性能优良的软磁材料,工业上常利用ZnFe(C2O4)3·6H2O隔绝空气加热分解制备,该晶体的热分解化学方程式为。测热分解后产品中ZnFe2O4的质量分数方法如下:取a克产品用H2SO4溶解后加入足量Kl溶液充分反应,调溶液至弱酸性,再加入淀粉指示剂,用cmol/LNa2S2O3标准溶渡滴定,用去此标准溶液vml时,刚好到达滴定终点,则此产品中ZnFe2O4的质量分数为(用a、c、v表示)。(已知:l2+2S2O32-=2l-+S4O62-)10. 深入研究碳元素的化合物有重要意义,回答下列问题:(1)、在恒温、恒容密闭容器中加入H2C2O4 , 发生反应:H2C2O4(s) CO2(g)+CO(g)+H2O(g),下列全叙述能说明反应已经达到平衡状态的是 。A、压强不再变化 B、CO2(g)的体积分数保持不变 C、混合气体的密度不再变化 D、混合气体的平均(2)、工业上可以通过CO(g)+2H2(g) CH3OH(g)制造甲醇在一容积可变容器中充入2molCO和4molH2 , CO的平衡转化率随温度(T)、压强(P)的变化关系如图所示,该反应的△H0(填“>”、“<”或”=”) ,比较A点时用CO表示的正反应速率与B点时用CH3OH表示的逆反应速率的大小V正(CO)V逆(CH3OH)(填”>”、”<”或“=”)。
若在压强p1下达到化学平衡状态A时,容器的体积为10L。如果反应开始时仍充入2molCO和4molH2 , 则在压强p2下达到平衡状态B时容器的体积V(B)=L。
(3)、从平衡移动的角度分析AlCl3溶液可以溶解CaCO3固体的原因是。(4)、常温下,测得某CaCO3的饱和溶液pH=10.0,忽略CO32-的第二步水解,计算Ksp(CaCO3)=(保留三位有效数字)(已知:Ka1(H2CO3)=4.4×10-7 Ka2(H2CO3)=4.7×10-11)(5)、有一种可充电电池Na-Al/FeS,电池工作时Na+的物质的量保持不变,并且用含Na+的导电固体作为电解质,已知该电池的正极反应式为2Na++FeS+2e-=Na2S+Fe,则放电时负极反应式为。该电池充电时,当转移2mol电子时,阳极质量的变化量为g。11. 第三代半导体材料氮化家(GaN)适合于制作高温、高频、抗辐射及大功率器件,通常称为高温半导体材料。回答下列问题:(1)、基态Ga原子价层电子的轨道表达式为 , 第一电离能介于N和B之间的第二周期元素有种。(2)、HCN分子中ο键与π键的数目之比为 , 其中ο键的对称方式为。与CN-互为等电子体的分子为。(3)、NaN3的是汽车安全气囊中的主要化学成分,其中阴离子中心原子的杂化轨道类型为。NF3的空间构型为。(4)、GaN、Gap、GaAs都是很好的半导体材料,品体类型与品体硅类似,熔点如下表所示,分析其变化原因。GaN
GaP
GaAs
熔点
1700℃
1480℃
1238℃
(5)、Ga晶胞结构如下图所示。已知六核柱底边边长为acm,阿伏加德罗常数的值NA。
①品胞中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为:
②GaN的密度为g·cm-3(用a、NA表示)。
12. 某化合物H的合成路线如下: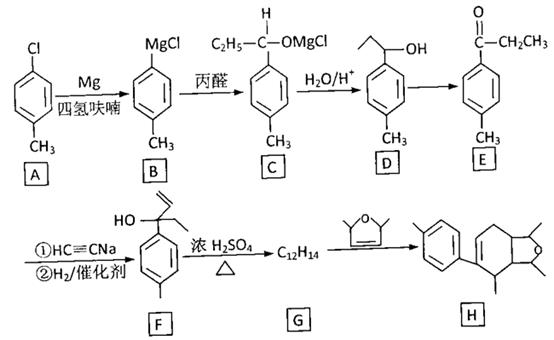
已知CH CH在NaNH2液氨条件下可生成CH CNa或NaC CNa
(1)、A的化学名称是 , B→C的反应类型是(2)、D→E的反应试剂、条件是 , F中不含氧官能团名称是(3)、H的分子式是(4)、F→G的化学方程式是(5)、W是E的同系物,比E少一个碳原子,则符合下列条件的W的同分异构体的结构简式是(写一种)①有两种官能团
②遇FeCl3溶液显紫色
③ 核磁共报氢谱有五组峰,峰面积之比是3:2:2:2:1
(6)、依据上述题目信息,写出用乙醛和乙炔为原料,制备化合物 的合成路线(无机试剂任选)。
的合成路线(无机试剂任选)。