湖南省新宁县二中2019届高二学业水平考试化学模拟试题
试卷更新日期:2019-04-23 类型:高考模拟
一、选择题(本题包括22小题,每小题2分,共44分。)
-
1. 下列气体中,呈黄绿色的是( )A、CH4 B、NO2 C、CO2 D、Cl22. 下列关于 和 的说法正确的是( )A、 核素中的中子数为8 B、 核素中的电子数为8 C、 核素中的质子数为14 D、 和 互为同位素.3. 下列物质中,不存在化学键的是( )A、氦气(He) B、氮气(N2) C、水(H2O) D、氯化钠(NaCl)4. 下列物质中,在高温下能与水蒸气反应生成金属氧化物和氢气的是( )A、Hg B、Ag C、Fe D、Cu5. 下列属于淀粉的特征反应的是( )A、在加热条件下,与新制的氢氧化铜反应产生砖红色沉淀 B、在常温下,遇碘变蓝 C、在加热条件下,与银氨溶液反应析出银 D、灼烧时有烧焦羽毛的特殊气味6. 下列变化需要加入还原剂才能实现的是( )A、Cu→Cu2+ B、Cl-→Cl2 C、MnO4-→Mn2+ D、NO→NO27. 在无色的酸性透明溶液中能大量共存的离子组是( )A、 、Mg2+、 、Cl- B、K+、Na+、Cl-、 C、Cu2+、Na+、 、 D、Ag+、Cu2+、 、Cl-8. 下列关于氯水的说法错误的是( )A、氯水中有Cl2、H+、Cl-、HClO、ClO、H2O和少量OH- B、氯水中只有HClO有氯化作用 C、氯水必须新制,久置的氯水就是稀盐酸 D、氯水呈黄绿色9. 在下列物质中加入少量金属钠,反应后有沉淀生成的是( )A、少量水 B、稀盐酸 C、CuSO4溶液 D、NaCl溶液10. PM2.5是指大气中直径小于或等于2.5×10-6m的颗粒物。今年PM2.5严重影响了我国人民的生产、生活和交通。下列有关PM2.5的说法不正确的是( )A、PM2.5可通过活性炭吸附而减轻危害 B、PM2.5是造成雾霾天气的最主要因素 C、燃放烟花爆竹,也会使空气中PM2.5的值增大 D、PM2.5分散在空气中,形成的是气溶胶11. 下列各图表示的装置中,能构成原电池的是( )A、NaOH溶液
 B、煤油
B、煤油  C、稀硫酸
C、稀硫酸  D、KOH溶液
D、KOH溶液  12. 下列物质不属于合金材料的是( )A、钢铁 B、硬铝 C、硅石 D、青铜13. 工业上冶炼单质Ag的反应为2Ag2O 4Ag+O2↑,该方法在金属冶冻中被称为( )A、电解法 B、热还原法 C、热分解法 D、置换法14. 日常生活和工业生产中常用到漂白剂。下列溶液具有漂白作用的是( )A、NaClO溶液 B、久置的氯水 C、KOH溶液 D、稀H2SO415. 下列各组物质发生反应,有红棕色气体产生的是( )A、Na和H2O B、Na2O2和H2O C、Cu和浓HNO3 D、Ca(OH)2和NH4Cl16. 一定条件下某密闭容器中发生反应l2(g)+H2(g) 2HI(g),达到化学平衡状态时,下列说法不正确的是( )A、正反应速率等于逆反应速率 B、HI的浓度不再变化 C、I2的浓度为0 D、H2的转化率达到最大17. 浓硫酸在加热条件下能与木炭反应,是因为浓硫酸具有( )A、吸水性 B、强酸性 C、脱水性 D、强氧化性18. 下列有关1mol NaOH的说法中,正确的是( )A、NaOH的摩尔质量为40g B、1mol NaOH的质量为40g/mol C、标准状况下,1mol NaOH所占的体积为22.4L D、将1mol NaOH溶于水配成100mL溶液,则溶液中溶质的物质的量浓度为10mol/L19. 要使下图构成原电池装置,且a作负极,则a是( )
12. 下列物质不属于合金材料的是( )A、钢铁 B、硬铝 C、硅石 D、青铜13. 工业上冶炼单质Ag的反应为2Ag2O 4Ag+O2↑,该方法在金属冶冻中被称为( )A、电解法 B、热还原法 C、热分解法 D、置换法14. 日常生活和工业生产中常用到漂白剂。下列溶液具有漂白作用的是( )A、NaClO溶液 B、久置的氯水 C、KOH溶液 D、稀H2SO415. 下列各组物质发生反应,有红棕色气体产生的是( )A、Na和H2O B、Na2O2和H2O C、Cu和浓HNO3 D、Ca(OH)2和NH4Cl16. 一定条件下某密闭容器中发生反应l2(g)+H2(g) 2HI(g),达到化学平衡状态时,下列说法不正确的是( )A、正反应速率等于逆反应速率 B、HI的浓度不再变化 C、I2的浓度为0 D、H2的转化率达到最大17. 浓硫酸在加热条件下能与木炭反应,是因为浓硫酸具有( )A、吸水性 B、强酸性 C、脱水性 D、强氧化性18. 下列有关1mol NaOH的说法中,正确的是( )A、NaOH的摩尔质量为40g B、1mol NaOH的质量为40g/mol C、标准状况下,1mol NaOH所占的体积为22.4L D、将1mol NaOH溶于水配成100mL溶液,则溶液中溶质的物质的量浓度为10mol/L19. 要使下图构成原电池装置,且a作负极,则a是( ) A、Al B、Cu C、Fe D、C(石墨)20. 下列反应属于吸热反应的是( )A、金属钠和水的反应 B、氯化铵和熟石灰在加热下制取氨气 C、稀硫酸与NaOH溶液的反应 D、木炭燃烧21. 为检验FeCl2溶液中是否含有Fe3+ , 可以选择的试剂是( )A、KSCN溶液 B、AgNO3溶液 C、酸性KMnO4溶液 D、BaCl2溶液22. “绿色化学”要求反应物中的原子全部转化为欲制的产物,即原子利用率为100%。下列反应最符合绿色化学中“原子经济”要求的是( )A、 B、3NO2+H2O=2HNO3+NO C、2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O D、2CH3CH2OH+O2 2CH3CHO+2H2O
A、Al B、Cu C、Fe D、C(石墨)20. 下列反应属于吸热反应的是( )A、金属钠和水的反应 B、氯化铵和熟石灰在加热下制取氨气 C、稀硫酸与NaOH溶液的反应 D、木炭燃烧21. 为检验FeCl2溶液中是否含有Fe3+ , 可以选择的试剂是( )A、KSCN溶液 B、AgNO3溶液 C、酸性KMnO4溶液 D、BaCl2溶液22. “绿色化学”要求反应物中的原子全部转化为欲制的产物,即原子利用率为100%。下列反应最符合绿色化学中“原子经济”要求的是( )A、 B、3NO2+H2O=2HNO3+NO C、2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O D、2CH3CH2OH+O2 2CH3CHO+2H2O二、填空题(本题包括4小题,每空2分,共26分)
-
23. 请根据物质在生产、生活等方面的应用填空:(1)、苏打水溶液中滴加酚酞溶液后,溶液呈(填“无”或“红”)色;(2)、检验某补铁剂中的Fe2+是否被氧化成Fe3+ , 可向该补铁剂溶液中加入KSCN溶液,若溶液(填“变红色“或“产生红褐色沉淀”),则Fe2+已被氧化成Fe3+;(3)、铝制餐具不宜长时间存放酸性、碱性食物,但常温下铝制容器可以整装浓硫酸,是由于铝在冷的浓硫酸中(填“不反应“或“钝化”),24. 浓硫酸具有的重要性质有:酸性、吸水性、脱水性、强氧化性。请把下列现象中浓硫酸表现出来的性质填写在对应的空白处:(1)、把浓硫酸滴在白纸上,白纸变黑,则浓硫酸表现出:;(2)、整有浓硫酸的烧杯敞口放置一段时间,质量增加,则浓硫酸表现出;(3)、旅硫酸与碳共热时发生反应2H2SO4(浓)+C CO2↑+2SO2↑+2H2O,在该反应中,浓硫酸表现出。25. 醋酸、淀粉、乙烯是中学化学中常见的三种有机物。请回答下列问题:
(1)、可作为植物生长调节剂的是;(2)、可作为食醋主要成分的是;(3)、能发生水解反应的是。26. 下表列出了①~⑥六种元素在元素周期表中的位置。
请回答下列问题:
(1)、表中④的元素符号是;(2)、①元素的最高价氧化物的化学式为;(3)、②和⑤的最简单氢化物稳定性最强的是(填化学式)。(4)、③的最高价氧化物对应的水化物与⑥的氢化物在溶液中相互反应的离子方程式是。三、实验题(本题包括1小题,每空2分,共10分)
-
27. 下图是实验室制取氮气的气体发生装置。请结合所学知识,回答下列问题;
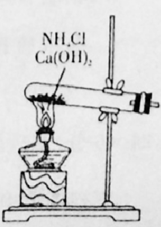 (1)、完成实验室制取氩气的化学方程式:2NH4Cl+Ca(OH)2 +2NH3↑+2H2O(2)、验证氨气是否已经收集满的方法是 (填字母代号)。A、将湿润的红色石蕊试纸靠近集气瓶口 B、将带火星的小木条放在集气瓶口(3)、若有10.7g氯化铵(摩尔质量是53.5g/mol)参加反应,则产生的氨气在标准状况下的体积为L。(4)、用收集满氨气的烧瓶做喷泉实验,装置如图所示(胶头滴管内预先吸入水,烧杯内盛有酚酞溶液),观察到产生红色喷泉,绕瓶内几乎充满红色液体。这说明氨气 , 氨水显性。
(1)、完成实验室制取氩气的化学方程式:2NH4Cl+Ca(OH)2 +2NH3↑+2H2O(2)、验证氨气是否已经收集满的方法是 (填字母代号)。A、将湿润的红色石蕊试纸靠近集气瓶口 B、将带火星的小木条放在集气瓶口(3)、若有10.7g氯化铵(摩尔质量是53.5g/mol)参加反应,则产生的氨气在标准状况下的体积为L。(4)、用收集满氨气的烧瓶做喷泉实验,装置如图所示(胶头滴管内预先吸入水,烧杯内盛有酚酞溶液),观察到产生红色喷泉,绕瓶内几乎充满红色液体。这说明氨气 , 氨水显性。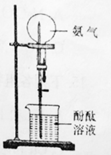
四、选做题
-
28.(1)、水是一种宝贵的自然资源。现有下列四种自来水厂和污水处理厂的常用试刻:
A.氯气(Cl2) B.明矾[KAl(SO4)2·12H2O]
C.熟石灰[Ca(OH)2 D.硫化钠(Na2S)
试用这四种试剂的字母代号回答下列问题;
①作净水剂,使水中的悬浮物形成絮状不溶物沉降的物质是;
②作消毒剂,常用于自来水杀菌消毒的物质是;
③作沉淀剂,常用于除去废水中的Hg2+等重金属离子的物质是;
④属于碱,常用于中和化工厂的酸性废水的物质是。
(2)、化学与生活密切相关。①下列药物中,有阻止细菌生长功能的抗生素是(填字母代号,下同):
A.麻黄碱B.青霉素D.阿司匹林
②使用过氧乙酸给环境消毒可杀死流感病毒,这是因为过氧乙酸能使蛋白质发生;
A.盐析B.颜色反应C.变性
③下列有关微量元素的说法中,不正确的是。
A.在食盐中加入碘酸钾可预防碘缺乏病
B.在酱油中加入铁强化剂可以解决缺铁性贫血问题
C人体内的钙元素属于微量元素
(3)、化学是材料科学的基础。①聚乙烯属于热塑性塑料,它在固态时的结构是(填“线型结构“或“体型网状结构”)。
②钢铁在湘湿的空气中会发生电化学腐蚀,其中(填“Fe”或“C”)是正极。负极反应是(填字母代号)。
A.Fe-2e-=Fe2+ B.O2+2H2O+4e-=4OH-
29.(1)、①25℃时,特pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合液的pH=7,则NaOH溶液与H2SO4 , 溶液的体积比为;②25℃时,pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)(填“=”“>”或“<”)c(CH3COO-)。
(2)、电解原理在化学工业中有广泛应用。如图表示一个电解泡,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
①若X、Y都是惰性电极,a是饱和NaCl溶液,)实验开始时,同时在两边各滴入几滴酚酞溶液,电解时Y电极上产生的物质是 , 该反应的总反应式是。
②如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是 , Y电极的主要电极反应式为 。
(3)、化学反应2A(g) B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示:实验序号
时间/浓度/温度
0
10
20
30
40
50
60
①
800℃
1.0
0.80
0.67
0.57
0.50
0.50
0.50
②
800℃
C2
0.60
0.50
0.50
0.50
0.50
0.50
③
800℃
C3
0.92
0.75
0.63
0.60
0.60
0.60
④
820℃
1.0
0.40
0.25
0.20
0.20
0.20
0.20
请根据上述数据,完成下列填空:
①在实验1中,反应在10~20min内反应物A的平均反应速率为mol/(L·min)。
②比较实验1和实验2,可推测c2=mol/L;若实验1和实验2在相同的压强下进行,但在实验2中,反应在20min时就已达到平衡,可推测实验2中还隐含的条件是
③比较实验1和实验4,可推测反应2A(g) B(g)+D(g)的正反应是(填“放热反应”或“吸热反应”)。
-