广东省深圳市2019年中考化学预测卷(四)
试卷更新日期:2019-04-19 类型:中考模拟
一、单选题
-
1. 下列工艺制作过程包含化学变化的是( )A、烧制陶瓷 B、裁剪窗花 C、雕刻玉石 D、编织竹篮2. 下列说法错误的是()A、铁制品在湖湿的空气中比在干燥的空气中易生锈 B、葡萄糖(C6H12O6)中C,H,O元素的质量比为1:2:1 C、地壳中含量最多的金属元素是Al D、分子都是由原子构成的3. 下列叙述符合实际且化学方程式书写正确的是()A、用氢氧化钠治疗胃酸过多:NaOH+HCl=NaCl+H2O B、碳酸钠溶液能使澄清的石灰水变浑浊:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓ C、实验室用过氧化氢溶液与二氧化猛混合制取氧气:H2O2 H2↑+O2↑ D、高炉炼铁的反应原理:Fe2O3+3CO Fe+3CO24. 铜元素有多种氧化物,如CuO、Cu2O。称取14.4 g仅含Cu、O两种元素的固体样品、采用如下装置实验(夹持装置省略)。测得实验前后装置B增重4.4g。下列说法正确的是( )
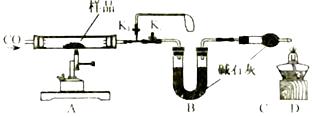 A、装置B的作用是吸收反应生成的H2O和CO2 B、实验开始前应先关闭K2 , 打开K1 , 让CO通一段时间 C、根据实验数据进行计算,可以确定该固体为Cu2O D、若缺少装置C,则实验所得Cu、O个数比偏高5. 如下所示的四个图像,分别对应四种过程,其中正确的是()A、①分别向等质量Mg和Cu中加入足量等质量、等浓度的稀硫酸
A、装置B的作用是吸收反应生成的H2O和CO2 B、实验开始前应先关闭K2 , 打开K1 , 让CO通一段时间 C、根据实验数据进行计算,可以确定该固体为Cu2O D、若缺少装置C,则实验所得Cu、O个数比偏高5. 如下所示的四个图像,分别对应四种过程,其中正确的是()A、①分别向等质量Mg和Cu中加入足量等质量、等浓度的稀硫酸 B、②分别向等质量且足量的Zn中加入等质量、不同浓度的稀硫酸
B、②分别向等质量且足量的Zn中加入等质量、不同浓度的稀硫酸  C、③分别向等质量且Mg和Zn中加入等质量、等浓度的稀硫酸
C、③分别向等质量且Mg和Zn中加入等质量、等浓度的稀硫酸  D、④分别向等质量的Mg和Zn中加入等质量、等浓度且定量的稀硫酸
D、④分别向等质量的Mg和Zn中加入等质量、等浓度且定量的稀硫酸  6. ZnSO4饱和溶液的溶质质量分数随温度变化的曲线如图所示。下列说法正确的是( )
6. ZnSO4饱和溶液的溶质质量分数随温度变化的曲线如图所示。下列说法正确的是( ) A、N点对应的ZnSO4溶液升温或降温均都可能析出晶体 B、M点对应的ZnSO4溶液是不饱和溶液 C、ZnSO4饱和溶液的溶质质量分数随温度升高而增大 D、40℃时,ZnSO4的溶解度为41g7. 下列各种溶质的溶液混合后无明显现象的一组是( )A、HCl、Na2CO3、K2SO4 B、KNO3、Ba(OH)2、NaCl C、KCl、AgNO3、HNO3 D、NaOH、FeCl3、(NH4)2SO48. 下列实验用品中,由有机合成材料制成的是( )A、
A、N点对应的ZnSO4溶液升温或降温均都可能析出晶体 B、M点对应的ZnSO4溶液是不饱和溶液 C、ZnSO4饱和溶液的溶质质量分数随温度升高而增大 D、40℃时,ZnSO4的溶解度为41g7. 下列各种溶质的溶液混合后无明显现象的一组是( )A、HCl、Na2CO3、K2SO4 B、KNO3、Ba(OH)2、NaCl C、KCl、AgNO3、HNO3 D、NaOH、FeCl3、(NH4)2SO48. 下列实验用品中,由有机合成材料制成的是( )A、 玻璃烧杯
B、
玻璃烧杯
B、 铁架台
C、
铁架台
C、 橡胶塞
D、
橡胶塞
D、 蒸发皿
9. 金属钨(W)可做白炽灯泡的灯丝。用黑钨矿[主要含有FeWO4(钨酸亚铁)]制得金属钨(W)的工艺流程如下图所示:
蒸发皿
9. 金属钨(W)可做白炽灯泡的灯丝。用黑钨矿[主要含有FeWO4(钨酸亚铁)]制得金属钨(W)的工艺流程如下图所示:
其主要反应原理如下:
①4FeWO4+4Na2CO3+O2 4Na2WO4+2Fe2O3+4CO2
②Na2WO4+2HCl(热浓)=H2WO4+2NaCl
③H2WO4 H2O+WO3
④3H2+WO3 W+3H2O下列说法错误的是()
A、反应③属于分解反应 B、反应①②③④的产物都有氧化物 C、反应①④中有元素的化合价发生改变 D、为加快反应的速率,可将黑钨矿石碾成粉末10. 除去物质中的少量杂质,下列实验方法不能达到实验目的是( )实验目的
实验方法
A
除去铜粉中混有的少量碳粉
在空气中充分灼烧
B
除去FeCl2溶液中的少量CuCl2
加入过量的铁粉、过滤
C
除去水中的空气
将水煮沸
D
除去CO2中混有的少量CO
将气体通过灼热的氧化铜
A、A B、B C、C D、D二、非选择题
-
11. A,B,C,D,E是九年级化学中常见的五种物质。已知C是人体胃液中可以帮助清化的物质,D是大理石的主要成分,其相互反应及转化关系如下图所示,“﹣“表示示相连的两物质之间能发生反应,“→”表示一种物质能转化为另一种物质,部分反应条件、反应物、生成物已略去。
 (1)、写出下列反应的化学方程式。
(1)、写出下列反应的化学方程式。C与D的反应:;B转化为A的反应:
C转化为A的反应:该反应属于反应(填基本反应类型)。
(2)、B与E的反应是(填“吸热”或“放热”)反应。(3)、写出E物质的一种用途12. 水是由氢、氧两种元素组成的化合物。这一结论是科学家们在大量实险的基础上得出的。(1)、实验室中常用锌粒和稀硫酸反应来制备氢气。请从下列装置中选择并组装一套制取干燥氢气的装置,符合题意的连接顺序为(用接口处字母填写)。 (2)、研究氢气的燃烧实验是人们认识水组成的开始。
(2)、研究氢气的燃烧实验是人们认识水组成的开始。①氢气在点燃前一定要。
②氢气在空气中燃烧时,若在火焰上方罩一冷而干燥的小烧杯,可观察到的现象是。在相同条件下,欲使1L氢气完全燃烧,所需空气至少约为L。
(3)、科学家们又用“电解法”证明了水的组成(装置如图所示,电极不与水及生成的气体反应)。电解时,水中需加入少量的NaOH,其作用是。通电一段时间后,发现甲、乙两量中筒收集的气体体积比略小于1:2,其原因可能是(写出一条即可)。
 (4)、拉瓦锡还用另一实验证明了水的组成。
(4)、拉瓦锡还用另一实验证明了水的组成。他让水蒸气通过一根烧红的铁质枪管,结果得到了氧气,同时枪管表面有黑色固体(磁铁矿的主要成分)生成。该反应的化学方程式为。
(5)、用“氢气还原氧化铜”实验也可以证明水的组成。
装置A中的玻璃管和其中物质在反应前后的质量差为m1 , 装置B和其中物质在反应前后的质量差为m2 , 据此可计算出水中O、H元素的质量比为(用含m1、m2的代数式表示)。实验时该比值往往略小于8:1,原因可能是(写出一条即可)。
13. 化学反应在防治环境污染中扮演了重要角色。某工厂废气中的SO2 , 可用以下方式处理。方式一:2SO2+O2+2CaO═2CaSO4 方式二:2SO2+O2+4NaOH═2Na2SO4+2H2O
试计算:
(已知:CaSO4的价格为700元/吨,相对分子质量为CaSO4 136 Na2SO4 142)。
(1)、CaSO4中有两种元素的质量分数呈整数倍关系,这两种元素是硫元素和。(2)、若用方式一处理9.6tSO2 , 所得产品价值多少元?(3)、若用方式二处理9.6tSO2 , 刚好用去50t一定浓度的NaOH溶液,求所得溶液的溶质质量分数(最终结果精确到0.1%)。