广东省深圳市2019年中考化学预测卷(二)
试卷更新日期:2019-04-19 类型:中考模拟
一、选择题
-
1. 以下我国古代的制作或技术涉及到化学变化的是( )A、
 烧制陶罐
B、
烧制陶罐
B、 雕刻石像
C、
雕刻石像
C、 水车灌溉
D、
水车灌溉
D、 预报地震
2. 硒是人体必需的一种微量元素,严重缺硒可能诱发皮肤病和癌症。硒的原子结构示意图及其在元素周期表中的某些信息如图所示,下列分析正确的是( )
预报地震
2. 硒是人体必需的一种微量元素,严重缺硒可能诱发皮肤病和癌症。硒的原子结构示意图及其在元素周期表中的某些信息如图所示,下列分析正确的是( )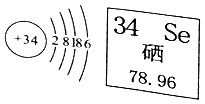 A、硒属于金属元素 B、硒的相对原子质量为78.96g C、硒原子的核电荷数为34 D、硒原子的核外有6个电子3. 下列反应的化学方程式书写错误的是( )A、Fe与稀HCl:2Fe+6HCl=2FeCl3+3H2↑ B、CO2使澄清石灰水变浑浊:CO2+Ca(OH)2=CaCO3↓+H2O C、Ba(OH)2溶液与稀H2SO4:Ba(OH)2+H2SO4=BaSO4↓+2H2O D、AgNO3溶液与稀HCl:AgNO3+HCl=AgCl↓+HNO34. 常温下向一定质量的稀盐酸中逐渐加入镁条,充分反应(忽略挥发)。下列图象正确的是()
A、硒属于金属元素 B、硒的相对原子质量为78.96g C、硒原子的核电荷数为34 D、硒原子的核外有6个电子3. 下列反应的化学方程式书写错误的是( )A、Fe与稀HCl:2Fe+6HCl=2FeCl3+3H2↑ B、CO2使澄清石灰水变浑浊:CO2+Ca(OH)2=CaCO3↓+H2O C、Ba(OH)2溶液与稀H2SO4:Ba(OH)2+H2SO4=BaSO4↓+2H2O D、AgNO3溶液与稀HCl:AgNO3+HCl=AgCl↓+HNO34. 常温下向一定质量的稀盐酸中逐渐加入镁条,充分反应(忽略挥发)。下列图象正确的是()①
 ②
②  ③
③  ④
④  A、①② B、②③ C、①④ D、②④5. KNO3与KCl的溶解度曲线如图所示。下列说法正确的是()
A、①② B、②③ C、①④ D、②④5. KNO3与KCl的溶解度曲线如图所示。下列说法正确的是() A、KNO3的溶解度比KCl的溶解度大 B、t1温度下的KCl的饱和溶液升温至t2 , 有晶体析出 C、A点所表示的KCl饱和溶液溶质的质量分数为29% D、冷却热的KNO3饱和溶液可获得KNO3晶体6. 下列有关实验现象的描述正确的是()A、红磷在空气中燃烧,产生大量白色烟雾 B、用粗砂纸打磨后的铝片放入硫酸铜溶液中,一段时间后,划痕处出现红色物质 C、铁丝在氧气中剧烈燃烧,火星四射,生成红色固体 D、向滴有石蕊的稀盐酸中滴加氢氧化钠溶液至过量,溶液由蓝色变紫色再变红色7. 制作下列物品所用的主要材料中,属于有机合成材料的是( )A、纯羊毛衫 B、木制桌椅 C、纯棉毛巾 D、食品保鲜膜(袋)8. 氧化铜与稀盐酸发生反应时,容器中溶液总质量随时间的变化由线如图所示。下列说法正确的是( )
A、KNO3的溶解度比KCl的溶解度大 B、t1温度下的KCl的饱和溶液升温至t2 , 有晶体析出 C、A点所表示的KCl饱和溶液溶质的质量分数为29% D、冷却热的KNO3饱和溶液可获得KNO3晶体6. 下列有关实验现象的描述正确的是()A、红磷在空气中燃烧,产生大量白色烟雾 B、用粗砂纸打磨后的铝片放入硫酸铜溶液中,一段时间后,划痕处出现红色物质 C、铁丝在氧气中剧烈燃烧,火星四射,生成红色固体 D、向滴有石蕊的稀盐酸中滴加氢氧化钠溶液至过量,溶液由蓝色变紫色再变红色7. 制作下列物品所用的主要材料中,属于有机合成材料的是( )A、纯羊毛衫 B、木制桌椅 C、纯棉毛巾 D、食品保鲜膜(袋)8. 氧化铜与稀盐酸发生反应时,容器中溶液总质量随时间的变化由线如图所示。下列说法正确的是( )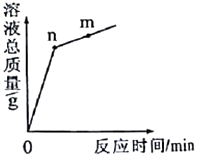 A、该实验是将氧化铜逐渐加入稀盐酸中 B、n点和m点对应溶液中铜元素质量不相等 C、n点和m点对应溶液蒸发结晶后得到的固体成分相同 D、该曲线不能反映溶液中溶剂质量随时间的变化关系9. 除去下列物质中的少量杂质所选的试剂正确的是()
A、该实验是将氧化铜逐渐加入稀盐酸中 B、n点和m点对应溶液中铜元素质量不相等 C、n点和m点对应溶液蒸发结晶后得到的固体成分相同 D、该曲线不能反映溶液中溶剂质量随时间的变化关系9. 除去下列物质中的少量杂质所选的试剂正确的是()选项
物质(括号内物质为杂质)
除杂试剂
A
FeCl2溶液(CuCl2)
过量铁粉
B
CO2(CO)
适量氧气
C
盐酸(硫酸)
适量Ba(NO3)2溶液
D
NaCl (NaOH)
适量稀硫酸
A、A B、B C、C D、D10. 石墨烯是一种革命性材料,具有优异的光学、电学和力学特性。图为金刚石、石墨和石墨烯的结构模型图,图中小球代表碳原子。下列说法正确的是()金刚石
 石墨
石墨  石墨烯
石墨烯 
①石墨烯是一种新型化合物
②三种物质分别在足量的氧气中完全燃烧的产物相同
⑨金刚石和石墨烯是组成相同但结构不同的两种物质
④石墨烯有超强的导电性和导热性,说明石墨烯的化学性质和金属相似
A、①④ B、②③ C、①③ D、②③④二、非选择题
-
11. A→L是初中化学常见物质,它们之间的转化关系如图13所示。(反应条件已略去)。其中G是大理石的主要成分,A和I为红色固体,B、D和L为气体。

请回答下列问题:
(1)、G的化学式为。(2)、E的组成元素在化合物中常呈现的化合价有。(3)、反应③的化学方程式为。(4)、上述转化中,B和L表现出相应的化学性质是。12. 如图为实验室中常用装置。
请回答下列问题:
(1)、仪器①的名称。(2)、实验室用氯酸钾和二氧化锰制取并收集较纯净的氧气,所选用的装置是(填装置字母),该反应的化学方程式为。若要从充分加热后的剩余固体中回收二氧化锰,符合题意的实验操作顺序是。(3)、通常状况下,氨气是一种无色、有强烈刺激性气味的污染性气体,极易溶解于水形成氨水,相同条件下密度比空气小。实验室中可以用浓氨水与生石灰制取氨气。请从如图中选出合适的仪器连接成一套制备并收集氨气的装置。则装置的接口连接顺序是→f.上述实验中,E装置的作用是。13. 某同学用如图装置验证质量守恒定律。称取一定质量的碳酸钠装入气球,将气球套在锥形瓶上。将药品全部倒入装有足量稀盐酸的锥形瓶中,气球迅速胀大。称量反应前后装置的总质量,实验数据如下表所示。
实验次数
1
2
3
碳酸钠质量/克
0.53
1.06
2.12
反应前装置总质量/克
66.33
66.86
67.92
反应后装置总质量/克
66.19
66.62
67.42
(1)、计算第1次反应产生的二氧化碳质量。(2)、分析数据发现每次反应前后装置的总质量均不相等,请以第1次反应为例,通过计算说明该反应是否遵循质量守恒定律。(空气密度取1.3克/升,二氧化碳密度取2.0克/升,结果精确到0.01)