2014年海南省高考化学试卷
试卷更新日期:2017-05-10 类型:高考真卷
一、选择题
-
1. 化学与日常生活密切相关,下列说法错误的是( )A、碘酒是指单质碘的乙醇溶液 B、84消毒液的有效成分是NaClO C、浓硫酸可刻蚀石英制艺术品 D、装饰材料释放的甲醛会造成污染2. 下列有关物质性质的说法错误的是( )A、热稳定性:HCl>HI B、原子半径:Na>Mg C、酸性:H2SO3>H2SO4 D、结合质子能力:S2﹣>Cl﹣3. 以石墨为电极,电解KI溶液(其中含有少量酚酞和淀粉).下列说法错误的是( )A、阴极附近溶液呈红色 B、阴极逸出气体 C、阳极附近溶液呈蓝色 D、溶液的pH变小4. 标准状态下,气态分子断开1mol化学键的焓变为键焓.已知H﹣H,H﹣O和O=O键的键焓△H分别为436kJ•mol﹣1、463kJ•mol﹣1和495kJ•mol﹣1 . 下列热化学方程式正确的是( )A、H2O(g)═H2(g)+ O2(g)△H=﹣485kJ•mol﹣1 B、H2O(g)═H2(g)+ O2(g)△H=+485kJ•mol﹣1 C、2H2(g)+O2(g)═2H2O(g)△H=+485kJ•mol﹣1 D、2H2(g)+O2(g)═2H2O(g)△H=﹣485kJ•mol﹣15. 下列除杂操作可行的是( )A、通过浓硫酸除去HCl中的H2O B、通过灼热的CuO除去H2中的CO C、通过灼热的镁粉除去N2中的O2 D、通过水除去CO中的CO26. NaOH溶液滴定盐酸实验中,不必用到的是( )A、酚酞 B、圆底烧杯 C、锥形瓶 D、碱式滴定管
二、选择题
-
7. 下列有关物质水解的说法正确的是( )A、蛋白质水解的最终产物是多肽 B、淀粉水解的最终产物是葡萄糖 C、纤维素不能水解成葡萄糖 D、油脂水解产物之一是甘油8. 某反应过程能量变化如图所示,下列说法正确的是( )
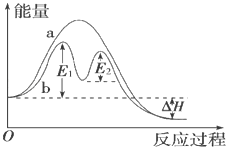 A、反应过程a有催化剂参与 B、该反应为放热反应,热效应等于△H C、改变催化剂,不能改变该反应的活化能 D、有催化剂条件下,反应的活化能等于E1+E29. 下列关于物质应用的说法错误的是( )A、玻璃容器可长期盛放各种酸 B、纯碱可用于清洗油污 C、浓氨水可检验氯气管道漏气 D、Na2S可除去污水中的Cu2+10. 下列关于物质应用和组成的说法正确的是( )A、P2O5可用于干燥Cl2和NH3 B、“可燃冰”主要成分是甲烷和水 C、CCl4可用于鉴别溴水和碘水 D、Si和SiO2都用于制造光导纤维11. 室温下,用0.100mol•L﹣1 NaOH溶液分别滴定20.00mL 0.100mol•L﹣1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
A、反应过程a有催化剂参与 B、该反应为放热反应,热效应等于△H C、改变催化剂,不能改变该反应的活化能 D、有催化剂条件下,反应的活化能等于E1+E29. 下列关于物质应用的说法错误的是( )A、玻璃容器可长期盛放各种酸 B、纯碱可用于清洗油污 C、浓氨水可检验氯气管道漏气 D、Na2S可除去污水中的Cu2+10. 下列关于物质应用和组成的说法正确的是( )A、P2O5可用于干燥Cl2和NH3 B、“可燃冰”主要成分是甲烷和水 C、CCl4可用于鉴别溴水和碘水 D、Si和SiO2都用于制造光导纤维11. 室温下,用0.100mol•L﹣1 NaOH溶液分别滴定20.00mL 0.100mol•L﹣1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )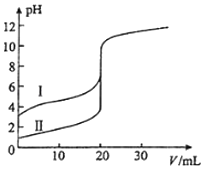 A、Ⅱ表示的是滴定醋酸的曲线 B、pH=7时,滴定醋酸消耗的V(NaOH)小于20mL C、V(NaOH)=20.00mL时,两份溶液中c(Cl﹣)=c(CH3COO﹣) D、V(NaOH)=10.00mL时,醋酸溶液中c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)12. 将BaO2放入密闭的真空容器中,反应2BaO2(s)⇌2BaO(s)+O2(g)达到平衡.保持温度不变,缩小容器体积,体系重新达到平衡,下列说法正确的是( )A、平衡常数减小 B、BaO量不变 C、氧气压强不变 D、BaO2量增加
A、Ⅱ表示的是滴定醋酸的曲线 B、pH=7时,滴定醋酸消耗的V(NaOH)小于20mL C、V(NaOH)=20.00mL时,两份溶液中c(Cl﹣)=c(CH3COO﹣) D、V(NaOH)=10.00mL时,醋酸溶液中c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)12. 将BaO2放入密闭的真空容器中,反应2BaO2(s)⇌2BaO(s)+O2(g)达到平衡.保持温度不变,缩小容器体积,体系重新达到平衡,下列说法正确的是( )A、平衡常数减小 B、BaO量不变 C、氧气压强不变 D、BaO2量增加三、解答题
-
13. 4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性,回答下列问题:
 (1)、元素x在周期表中的位置是第周期,第族,其单质可采用电解熔融的方法制备.(2)、m、n、y三种元素最高价氧化物的水化物中,酸性最强的是 , 碱性最强的是 . (填化学式)(3)、气体分子(mn)2的电子式为 . (mn)2成为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为 .14. 硝基苯甲酸乙酯在OH﹣存在下发生水解反应:
(1)、元素x在周期表中的位置是第周期,第族,其单质可采用电解熔融的方法制备.(2)、m、n、y三种元素最高价氧化物的水化物中,酸性最强的是 , 碱性最强的是 . (填化学式)(3)、气体分子(mn)2的电子式为 . (mn)2成为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为 .14. 硝基苯甲酸乙酯在OH﹣存在下发生水解反应:O2NC6H4COOC2H5+OH﹣⇌O2NC6H4COO﹣+C2H5OH
两种反应物的初始浓度均为0.050mol•L﹣1 , 15℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示.回答下列问题:
t/s
0
120
180
240
330
530
600
700
800
α/%
0
33.0
41.8
48.8
58.0
69.0
70.4
71.0
71.0
(1)、列示计算该反应在120~180s与180~240s区间的平均反应速率、;比较两者大小可得出的结论是 .(2)、列式计算15℃时该反应的平衡常数 .(3)、为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可采取的措施有(要求写出两条).15. 卤代烃在生产生活中具有广泛的应用,回答下列问题:(1)、多卤代甲烷常作为有机溶剂,其中分子结构为正四面体的是 . 工业上分离这些多氯代甲烷的方法是 .(2)、三氟氯溴乙烷(CF3CHClBr)是一种麻醉剂,写出其所有同分异构体的结构简式(不考虑立体异构).(3)、聚氯乙烯是生活中常用的塑料.工业生产聚氯乙烯的一种工艺路线如下: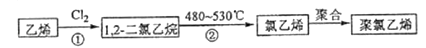
反应①的化学方程式为 , 反应类型为;反应②的反应类型为 .
16. 锰锂电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2 . 回答下列问题: (1)、外电路的电流方向是由极流向极(填字母).(2)、电池正极反应式 .(3)、是否可用水代替电池中的混合有机溶剂?(填“是”或“否”),原因是 .(4)、MnO2可与KOH和KClO3在高温下反应,生成K2MnO4 , 反应的化学方程式为 . K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为 .17. 硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.回答下列问题:
(1)、外电路的电流方向是由极流向极(填字母).(2)、电池正极反应式 .(3)、是否可用水代替电池中的混合有机溶剂?(填“是”或“否”),原因是 .(4)、MnO2可与KOH和KClO3在高温下反应,生成K2MnO4 , 反应的化学方程式为 . K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为 .17. 硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.回答下列问题: (1)、b中反应的离子方程式为 , c中的试剂为 .
(1)、b中反应的离子方程式为 , c中的试剂为 .
(2)、反应开始后,c中先有浑浊产生,后又变澄清.此浑浊物是 .(3)、d中的试剂为 .(4)、试验中要控制SO2生成速率,可以采取的措施有(写出两条).(5)、为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是 .四、选做题,请考生在选修5、选修3、选修2三题中任选一题作答,多做则按所做的第一题计分选修5-有机化学基础
-
18. 图示为一种天然产物,具有一定的除草功效.下列有关该化合物的说法错误的是( )
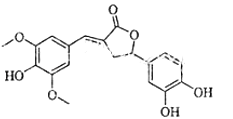 A、分子含有三种含氧官能团 B、1mol该化合物最多能与6mol NaOH反应 C、既可以发生取代反应,又能够发生加成反应 D、既能与FeCl3发生显色反应,也能与NaHCO3反应放出CO219. 1,6﹣已二酸(G)是合成尼龙的主要原料之一,可用含六个碳原子的有机化合物氧化制备.如图为A通过氧化反应制备G的反应过程(可能的反应中间物质为B、C、D、E和F):
A、分子含有三种含氧官能团 B、1mol该化合物最多能与6mol NaOH反应 C、既可以发生取代反应,又能够发生加成反应 D、既能与FeCl3发生显色反应,也能与NaHCO3反应放出CO219. 1,6﹣已二酸(G)是合成尼龙的主要原料之一,可用含六个碳原子的有机化合物氧化制备.如图为A通过氧化反应制备G的反应过程(可能的反应中间物质为B、C、D、E和F):
回答下列问题:
(1)、化合物A中含碳87.8%,其余为氢,A的化学名称为 .(2)、B到C的反应类型为 .(3)、F的结构简式为 .(4)、在上述中间物质中,核磁共振氢谱出峰最多的是 , 最少的是 . (填化合物代号)(5)、由G合成尼龙的化学方程式为 .(6)、由A通过两步反应制备1,3﹣环已二烯的合成路线为 .五、选修3-物质的结构与性质
-
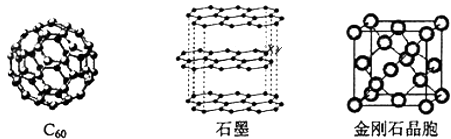
20. 对于钠的卤化物(NaX)和硅的卤化物(SiX4),下列叙述正确的是( )A、SiX4难水解 B、SiX4是共价化合物 C、NaX易水解 D、NaX的熔点一般高于SiX421. 碳元素的单质有多种形式,如图依次是C60、石墨和金刚石的结构图:
回答下列问题:
(1)、金刚石、石墨、C60、碳纳米管都是碳元素的单质形式,它们互为 .(2)、金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为、 .(3)、C60属于晶体,石墨属于晶体.(4)、石墨晶体中,层内C﹣C键的键长为142pm,而金刚石中C﹣C键的键长为154pm.其原因是金刚石中只存在C﹣C间的共价键,而石墨层内的C﹣C间不仅存在共价键,还有键.(5)、金刚石晶胞含有个碳原子.若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=a,列式表示碳原子在晶胞中的空间占有率(不要求计算结果).六、选修2-化学
-
22. 下列有关叙述正确的是( )A、碱性锌锰电池中,MnO2是催化剂 B、银锌纽扣电池工作时,Ag2O被还原为Ag C、放电时,铅酸蓄电池中硫酸浓度不断增大 D、电镀时,待镀的金属制品表面发生还原反应23. 锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌.某含锌矿的主要成分是ZnS(还含有少量FeS等其它成分),以其为原料炼锌的工艺流程如图所示:

回答下列问题:
(1)、硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为 .(2)、焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的操作.(3)、浸出液“净化”过程中加入的主要物质为 , 其作用是 .(4)、电解沉积过程中的阴极采用铝板,阳极采用Pb﹣Ag合金惰性电极,阳极逸出的气体是 .(5)、改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种由工业价值的非金属单质,“氧压酸浸”中发生主要反应的离子方程式为 .(6)、我国古代曾采用“火法”工艺冶炼锌.明代宋应星著《天工开物》中有关“升炼倭铅”的记载:“炉甘石十斤,装载入一尼罐内,…,然后逐层用煤炭饼垫盛,其底铺薪,发火锻红,…,冷淀,毁罐取出,…即倭铅也.”该炼锌工艺主要反应的化学方程式为 . (注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌).