2014年广西南宁市中考化学试卷
试卷更新日期:2017-05-10 类型:中考真卷
一、选择题
-
1. 下列气体属于空气污染物的是( )A、氮气 B、氧气 C、二氧化硫 D、二氧化碳2. 下列四种金属中,活动性最弱的是( )A、Mg B、Al C、Zn D、Ag3. 下列数据为常见水果的近似pH,其中呈碱性的是( )A、
 菠萝pH=5.1
B、
菠萝pH=5.1
B、 杨梅pH=2.5
C、
杨梅pH=2.5
C、 苹果pH=4.1
D、
苹果pH=4.1
D、 柿子pH=8.5
4. 下列食品或调味品的制作过程中,没有新物质生成的是( )A、牛奶变酸奶 B、用水果榨成果汁 C、粮食酿白酒 D、用面粉和小苏打发酵做馒头5. 下列物质属于化合物的是( )A、空气 B、氧气 C、生铁 D、氯化钾6. 下列化学符号中,表示2个氢分子的是( )A、H2 B、2H C、2H2 D、2H+7. 下列实验基本操作中,正确的是( )A、
柿子pH=8.5
4. 下列食品或调味品的制作过程中,没有新物质生成的是( )A、牛奶变酸奶 B、用水果榨成果汁 C、粮食酿白酒 D、用面粉和小苏打发酵做馒头5. 下列物质属于化合物的是( )A、空气 B、氧气 C、生铁 D、氯化钾6. 下列化学符号中,表示2个氢分子的是( )A、H2 B、2H C、2H2 D、2H+7. 下列实验基本操作中,正确的是( )A、 检查装置气密性
B、
检查装置气密性
B、 点燃酒精灯
C、
点燃酒精灯
C、 称量固体
D、
称量固体
D、 倾倒液体
8. 下列做法中,不利于节约用水的是( )A、用淘米水浇花 B、用洗过衣服的水冲厕所 C、将隔夜的白开水直接倒掉 D、洗澡擦沐浴露时暂时关闭水龙头9. 下列有关溶液的说法中,正确的是( )A、溶液都是无色透明的 B、溶液中的溶剂一定是水 C、均一、稳定液体都是溶液 D、溶液都是由溶质和溶剂组成的10. 氧元素和硫元素最本质的区别是( )A、质子数不同 B、相对原子质量不同 C、电子数不同 D、最外层电子数不同11. 被称之为“软电池”的纸质电池,采用薄层纸片作为传导体,电池总反应为:Zn+2MnO2+H2O=ZnO+2MnO(OH),避免了传统电池所带来的污染问题,因而废旧的纸质电池可作为一般的废弃物加以处理.下列说法错误的是( )
倾倒液体
8. 下列做法中,不利于节约用水的是( )A、用淘米水浇花 B、用洗过衣服的水冲厕所 C、将隔夜的白开水直接倒掉 D、洗澡擦沐浴露时暂时关闭水龙头9. 下列有关溶液的说法中,正确的是( )A、溶液都是无色透明的 B、溶液中的溶剂一定是水 C、均一、稳定液体都是溶液 D、溶液都是由溶质和溶剂组成的10. 氧元素和硫元素最本质的区别是( )A、质子数不同 B、相对原子质量不同 C、电子数不同 D、最外层电子数不同11. 被称之为“软电池”的纸质电池,采用薄层纸片作为传导体,电池总反应为:Zn+2MnO2+H2O=ZnO+2MnO(OH),避免了传统电池所带来的污染问题,因而废旧的纸质电池可作为一般的废弃物加以处理.下列说法错误的是( ) A、该电池反应中锌元素化合价升高 B、该电池反应中二氧化锰作催化剂 C、其工作原理是将化学能转化为电能 D、开发利用该电池可以减少对环境的污染12. 下列有关水的说法错误的是( )A、水是氧化物 B、煮沸可降低自来水的硬度 C、肥皂水可区分硬水和软水 D、电解水的实验,说明水是由氢气和氧气组成的13. 2014年6月10日是“全国低碳日”,主题是“携手节能低碳,共建碧水蓝天”.下列做法不符合“节能低碳”理念的是( )A、提倡双面使用纸张 B、推广使用一次性竹筷 C、提倡使用太阳能热水器 D、推广使用公共自行车14. 下列有关碳和碳的氧化物的说法中,错误的是( )A、一氧化碳和二氧化碳都有毒 B、木炭、活性炭都具有吸附性 C、木炭、一氧化碳在一定条件下都能与氧化铜反应 D、金刚石和石墨物理性质不同,是因为它们的碳原子排列方式不同15. 认识燃烧原理可以利用和控制燃烧,下列说法正确的是( )A、物质与氧气反应时都会发生燃烧 B、只要达到燃烧所需的最低温度,可燃物就能燃烧 C、把木柴架空,可使木柴更充分接触空气而燃烧得更旺 D、用嘴吹蜡烛,蜡烛熄灭是因为降低了蜡烛的着火点16. 下列化学方程式,书写完全正确的是( )A、C+CO2 2CO B、CO+Fe2O3 2Fe+CO2 C、Ca(OH)2+HCl=CaCl+H2O D、2KMnO4 K2MnO4+MnO2+O217. 将等质量的镁和铁分别放入等质量、相同质量分数的稀盐酸中,产生氢气的质量和反应时间的关系如图所示,下列说法错误的是( )
A、该电池反应中锌元素化合价升高 B、该电池反应中二氧化锰作催化剂 C、其工作原理是将化学能转化为电能 D、开发利用该电池可以减少对环境的污染12. 下列有关水的说法错误的是( )A、水是氧化物 B、煮沸可降低自来水的硬度 C、肥皂水可区分硬水和软水 D、电解水的实验,说明水是由氢气和氧气组成的13. 2014年6月10日是“全国低碳日”,主题是“携手节能低碳,共建碧水蓝天”.下列做法不符合“节能低碳”理念的是( )A、提倡双面使用纸张 B、推广使用一次性竹筷 C、提倡使用太阳能热水器 D、推广使用公共自行车14. 下列有关碳和碳的氧化物的说法中,错误的是( )A、一氧化碳和二氧化碳都有毒 B、木炭、活性炭都具有吸附性 C、木炭、一氧化碳在一定条件下都能与氧化铜反应 D、金刚石和石墨物理性质不同,是因为它们的碳原子排列方式不同15. 认识燃烧原理可以利用和控制燃烧,下列说法正确的是( )A、物质与氧气反应时都会发生燃烧 B、只要达到燃烧所需的最低温度,可燃物就能燃烧 C、把木柴架空,可使木柴更充分接触空气而燃烧得更旺 D、用嘴吹蜡烛,蜡烛熄灭是因为降低了蜡烛的着火点16. 下列化学方程式,书写完全正确的是( )A、C+CO2 2CO B、CO+Fe2O3 2Fe+CO2 C、Ca(OH)2+HCl=CaCl+H2O D、2KMnO4 K2MnO4+MnO2+O217. 将等质量的镁和铁分别放入等质量、相同质量分数的稀盐酸中,产生氢气的质量和反应时间的关系如图所示,下列说法错误的是( ) A、反应结束后镁一定有剩余 B、反应消耗盐酸的总质量一定相等 C、0﹣t1时段,产生氢气的质量镁比铁大 D、0﹣t2时段,参加反应的镁的质量与铁相等18. 做木炭在氧气中燃烧的实验时,实验现象不明显,原因可能是收集本实验所用氧气过程中( )A、用向下排空气法收集氧气 B、将满氧气的集气瓶正放在桌面上 C、收集满氧气后,在水面下用玻璃片盖住瓶口移出水槽 D、收集氧气时,观察到导管口气泡连续均匀放出时开始收集19. 下列有关二氧化碳的说法正确的是( )A、实验室常用块状石灰石和稀硫酸反应制取二氧化碳气体 B、二氧化碳用于人工灭火,既利用了它的物理性质也利用了它的化学性质 C、将二氧化碳气体通入紫色石蕊试液中,溶液呈红色,说明二氧化碳显酸性 D、将燃着的木条伸入一瓶气体中,木条立即熄灭,证明瓶内原有气体就是二氧化碳20. 一定条件下,甲、乙、丙、丁四种物质在密闭容器中反应,测得反应前后各物质的质量分数如图所示,下列说法正确的是( )
A、反应结束后镁一定有剩余 B、反应消耗盐酸的总质量一定相等 C、0﹣t1时段,产生氢气的质量镁比铁大 D、0﹣t2时段,参加反应的镁的质量与铁相等18. 做木炭在氧气中燃烧的实验时,实验现象不明显,原因可能是收集本实验所用氧气过程中( )A、用向下排空气法收集氧气 B、将满氧气的集气瓶正放在桌面上 C、收集满氧气后,在水面下用玻璃片盖住瓶口移出水槽 D、收集氧气时,观察到导管口气泡连续均匀放出时开始收集19. 下列有关二氧化碳的说法正确的是( )A、实验室常用块状石灰石和稀硫酸反应制取二氧化碳气体 B、二氧化碳用于人工灭火,既利用了它的物理性质也利用了它的化学性质 C、将二氧化碳气体通入紫色石蕊试液中,溶液呈红色,说明二氧化碳显酸性 D、将燃着的木条伸入一瓶气体中,木条立即熄灭,证明瓶内原有气体就是二氧化碳20. 一定条件下,甲、乙、丙、丁四种物质在密闭容器中反应,测得反应前后各物质的质量分数如图所示,下列说法正确的是( )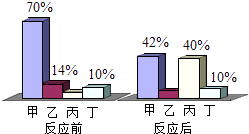 A、丁是该反应的催化剂 B、该反应的基本类型是分解反应 C、该反应中乙、丙的质量比为3:17 D、该反应中甲、丙的质量比为7:10
A、丁是该反应的催化剂 B、该反应的基本类型是分解反应 C、该反应中乙、丙的质量比为3:17 D、该反应中甲、丙的质量比为7:10二、填空题
-
21. 化学就在我们身边,运用所学的化学知识回答:(1)、现有聚乙烯塑料、食盐、硝酸铵、甲烷、牛奶五种物质,其中:
①属于氮肥的是;
②富含蛋白质的是;
③天然气的主要成分是;
④可用作厨房调味品的是;
⑤属于有机合成材料的是;
(2)、为了预防佝偻病,幼儿及青少年可适当补充一些富含元素的食品.22. 广西矿产资源丰富,铟的生产规模居世界同类企业首位,图1是元素周期表中铟元素的信息,图2是铟原子的结构示意图,回答下列问题: (1)、铟元素属于元素,其原子核外共有个电子层.(2)、在化学反应中,铟原子容易电子形成铟离子,铟离子的化学符号为
(1)、铟元素属于元素,其原子核外共有个电子层.(2)、在化学反应中,铟原子容易电子形成铟离子,铟离子的化学符号为.
(3)、画出第13号元素的原子结构示意图 . 该元素与铟元素在元素周期表中处于同一个(填“周期”或“族”)23. 如图是几种化合物通过一步反应转化为含锌化合物M的转化关系图. (1)、物质M属于(填“酸”、“碱”或“盐”).(2)、写出转化②发生反应的化学方程式: .(3)、写出符合转化①反应的规律: .24. 如图是氯化钾和硝酸钾两种固体溶解度曲线图.
(1)、物质M属于(填“酸”、“碱”或“盐”).(2)、写出转化②发生反应的化学方程式: .(3)、写出符合转化①反应的规律: .24. 如图是氯化钾和硝酸钾两种固体溶解度曲线图. (1)、20℃时,KNO3的溶解度是(填“大于”、“小于”或“等于”)KCl的溶解度.(2)、40℃时,KCl的溶解度是g,向100g水中加入40gKCl,所得溶液中溶质与溶液的质量比为 .(3)、比较这两种物质溶解度曲线的变化规律,从中你可以获得哪些信息:(任写一条).(4)、下列说法正确的是 .A、KNO3饱和溶液一定比不饱和溶液浓 B、饱和KCl溶液析出晶体后,溶液中溶质的质量分数可能不变 C、30℃时,分别将10g KCl和10g KNO3配制成饱和溶液,前者需要水的质量较多 D、分别将40℃时的KCl和KNO3的饱和溶液降温到20℃时,后者析出的晶体较多.25. 某碳酸钾固体样品,可能含有硫酸钾、碳酸钙、硫酸铜、氯化钾、氯化钙中的一种或几种杂质,为了确定杂质的成分,进行以下实验:
(1)、20℃时,KNO3的溶解度是(填“大于”、“小于”或“等于”)KCl的溶解度.(2)、40℃时,KCl的溶解度是g,向100g水中加入40gKCl,所得溶液中溶质与溶液的质量比为 .(3)、比较这两种物质溶解度曲线的变化规律,从中你可以获得哪些信息:(任写一条).(4)、下列说法正确的是 .A、KNO3饱和溶液一定比不饱和溶液浓 B、饱和KCl溶液析出晶体后,溶液中溶质的质量分数可能不变 C、30℃时,分别将10g KCl和10g KNO3配制成饱和溶液,前者需要水的质量较多 D、分别将40℃时的KCl和KNO3的饱和溶液降温到20℃时,后者析出的晶体较多.25. 某碳酸钾固体样品,可能含有硫酸钾、碳酸钙、硫酸铜、氯化钾、氯化钙中的一种或几种杂质,为了确定杂质的成分,进行以下实验:①取少量样品溶于水得到无色溶液,然后滴加过量的氯化钡溶液,出现白色沉淀A,过滤.
②沉淀A中加入过量的稀硝酸,沉淀部分消失并放出气体.往步骤①所得的滤液中加入适量硝酸银溶液和稀硝酸,生成白色沉淀B,过滤.回答下列问题:
(1)、白色沉淀B是 , 步骤②中放出的气体是 .(2)、杂质中一定含有 , 一定没有 .(3)、最终所得滤液中含有的阳离子是 .三、我会回答
-
26. 第45届世界体操锦标赛将于2014年10月3日至12日在广西体育中心体育馆举行.(1)、体育馆内照明灯的导线大多数是铜导线,用铜做导线是利用金属铜的性和性.(2)、体育馆雄伟壮观的主体建筑使用了大量的金属铝板,铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,反应的化学方程式是 .(3)、本届锦标赛吉祥物“南南”和“宁宁”,其外材料为纯羊毛,内充PET纤维[化学式为(C10H8O4)n].PET纤维由元素组成.
 27. A~F为初中化学常见的六种物质,且都含有一种相同元素,它们相互间的关系如图所示.已知A,B,C,D,E是不同类别的物质,C俗称纯碱,F是人体中含量最多的物质.(部分反应物、生成物及反应条件己略去)
27. A~F为初中化学常见的六种物质,且都含有一种相同元素,它们相互间的关系如图所示.已知A,B,C,D,E是不同类别的物质,C俗称纯碱,F是人体中含量最多的物质.(部分反应物、生成物及反应条件己略去)请回答:
 (1)、写出A,D,F的化学式:A , D , F .(2)、写出B物质的一种用途 , C与E反应的化学方程式是 .(3)、图中物质相互间发生的反应.未涉及的基本反应类型是 .
(1)、写出A,D,F的化学式:A , D , F .(2)、写出B物质的一种用途 , C与E反应的化学方程式是 .(3)、图中物质相互间发生的反应.未涉及的基本反应类型是 .四、我会实验
-
28. 在2014年南宁市理化实验操作考试中.小刚同学选择了稀盐酸、氢氧化钠溶液、酚酞溶液三种试剂,按如图所示进行酸碱中和反应的实验.
请回答:
 (1)、试剂Ⅰ是 , 试剂Ⅱ是 .(2)、本实验中,常常选用酚酞酞溶液而不选用石蕊溶液做指示剂的原因是 .(3)、欲验证上述实验中稀盐酸和氢氧化钠溶液是否恰好完全反应,不能选择的试剂是 .A、石蕊溶液 B、铜片 C、碳酸氢钠粉末.29. 如图所示,某校化学兴趣小组用过氧化氢(H2O2)溶液(MnO2作催化剂)制取干燥的氧气,并用来侧定,10g某铜粉样品(含杂质碳)中铜的质量分数.回答下列问题:
(1)、试剂Ⅰ是 , 试剂Ⅱ是 .(2)、本实验中,常常选用酚酞酞溶液而不选用石蕊溶液做指示剂的原因是 .(3)、欲验证上述实验中稀盐酸和氢氧化钠溶液是否恰好完全反应,不能选择的试剂是 .A、石蕊溶液 B、铜片 C、碳酸氢钠粉末.29. 如图所示,某校化学兴趣小组用过氧化氢(H2O2)溶液(MnO2作催化剂)制取干燥的氧气,并用来侧定,10g某铜粉样品(含杂质碳)中铜的质量分数.回答下列问题: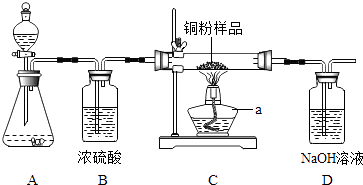 (1)、仪器a的名称是 .(2)、装置A中发生反应的化学方程式是 . 装置B的作用是 .(3)、通过称量反应前后装置的质量,进行计算便可求出样品中铜的质量分数.(4)、实验完毕.小丽同学误将用剩的H2O2溶液和装置C玻璃管中的剩余固体一起倒入烧杯中,发现有大量的气泡产生,经检验确认产生的气体是氧气.小刚和小明两位同学对此颇感兴趣.进而展开了他们的探究之旅.
(1)、仪器a的名称是 .(2)、装置A中发生反应的化学方程式是 . 装置B的作用是 .(3)、通过称量反应前后装置的质量,进行计算便可求出样品中铜的质量分数.(4)、实验完毕.小丽同学误将用剩的H2O2溶液和装置C玻璃管中的剩余固体一起倒入烧杯中,发现有大量的气泡产生,经检验确认产生的气体是氧气.小刚和小明两位同学对此颇感兴趣.进而展开了他们的探究之旅.【提出问题】是哪种物质加快了H2O2的分解速率?
【大胆猜想】猜想Ⅰ:剩余固体中的氧化铜加快了H2O2溶液的分解.
猜想Ⅱ:剩余固体中的加快了H2O2溶液的分解.
猜想Ⅲ:氧化铜能做H2O2分解的催化剂.
(5)、【实验验证】实验方案
实验现象
分析及结论
实验一:将带火星的木条伸入盛有5mL 5%H2O2溶液的试管.
带火星木条不复燃
H2O2溶液常温下产生氧气的量很少,不足以使带火星的木条复燃
实验二:向盛有5mL5%H2O2溶液的试管中加入1g氧化铜固体,将一根带火星的木条伸入试管.观察现象.待反应结束后将试管里的剩余物进行、洗涤、干燥、称量.对比反应前后氧化铜的质量
称得固体质量为1g.
猜想Ⅰ成立.反应前后氧化铜的质量相等.
实验三:向盛有5mL5%H2O2溶液的试管中加入1g
, 将一根带火星的木条伸入试管,观察现象.
没有气泡产生,带火星
木条不复燃.
猜想Ⅱ(填”成立“或“不成立”)
【讨论交流】小刚同学认为,根据实验二得出的两个结论就能判断Ⅲ成立,你是否支持他的观点?并简述理由.
答: . .
五、我会计算
-
30. 往盛有28.8g碳酸钙和氯化钙混合物的烧杯中加入100.0g稀盐酸,恰好完全反应,得到120.0g溶液.计算:(1)、产生气体的质量为g.(2)、反应后所得溶液中溶质的质量分数.