上海市松江区2018-2019学年高考化学一模考试试卷
试卷更新日期:2019-04-15 类型:高考模拟
一、单选题
-
1. 下列过程属于物理变化的是( )A、干馏 B、分馏 C、裂化 D、裂解2. 属于硝态氨肥的是( )A、CO(NH2)2 B、NH4Cl C、KNO3 D、NH3·H2O3. 海水中含量最高的非金属元素是( )A、O B、Cl C、Br D、I4. 下列物质熔化时只克服分子间作用力的是( )A、钢铁 B、冰 C、水晶 D、食盐5. 下列化学用语表示错误的是( )A、碳原子的结构示意图:
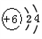 B、CO2分子的电子式:
B、CO2分子的电子式: 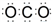 C、碳原子核外电子排布的轨道表达式:
C、碳原子核外电子排布的轨道表达式: 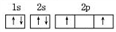 D、CO2分子的比例模型:
D、CO2分子的比例模型:  6. 下列变化过程属于还原反应的是( )A、HCl→Cl2 B、H2SO3→SO2 C、Fe(OH)3→Fe2O3 D、CuO→Cu7. 不能用离子方程式Ca2++CO32- →CaCO3↓表示的反应是( )A、澄清石灰水和碳酸 B、澄清石灰水和碳酸钠溶液 C、硝酸钙溶液和碳酸铵溶液 D、氯化钙溶液和碳酸钾溶液8. 对核外电子运动状态的描述,较为全面的是( )A、结构示意图 B、电子式 C、电子排布式 D、轨道表达式9. 将后者逐渐滴入(或通入)前者至过量,先产生沉淀后消失的是( )A、AlCl3溶液、氨水 B、H2S溶液、O2 C、Al2(SO4)3溶液、NaOH溶液 D、FeCl2溶液、NaOH 溶液10. 不能用元素周期律解释的是( )A、酸性: H2SO4>H3PO4 B、非金属性: Cl> Br C、碱性: NaOH> Mg(OH)2 D、热稳定性: Na2CO3> NaHCO311. 关于
6. 下列变化过程属于还原反应的是( )A、HCl→Cl2 B、H2SO3→SO2 C、Fe(OH)3→Fe2O3 D、CuO→Cu7. 不能用离子方程式Ca2++CO32- →CaCO3↓表示的反应是( )A、澄清石灰水和碳酸 B、澄清石灰水和碳酸钠溶液 C、硝酸钙溶液和碳酸铵溶液 D、氯化钙溶液和碳酸钾溶液8. 对核外电子运动状态的描述,较为全面的是( )A、结构示意图 B、电子式 C、电子排布式 D、轨道表达式9. 将后者逐渐滴入(或通入)前者至过量,先产生沉淀后消失的是( )A、AlCl3溶液、氨水 B、H2S溶液、O2 C、Al2(SO4)3溶液、NaOH溶液 D、FeCl2溶液、NaOH 溶液10. 不能用元素周期律解释的是( )A、酸性: H2SO4>H3PO4 B、非金属性: Cl> Br C、碱性: NaOH> Mg(OH)2 D、热稳定性: Na2CO3> NaHCO311. 关于 的命名正确的是( ) A、3-甲基庚烷 B、2-乙基己烷 C、1-甲基-4-乙基戊烷 D、1, 4-二甲基己烷12. 能够确定溶液中一定含有SO42-的是( )A、取样,加入用盐酸酸化的氯化钡溶液,有白色沉淀生成 B、取样,加入氯化钡溶液,有白色沉淀生成,再加稀硝酸沉淀不消失 C、取样,加入硝酸钡溶液,有白色沉淀生成 D、取样,加入盐酸无现象,再加氯化钡溶液,有白色沉淀生成13. 已达到平衡的可逆反应,增大压强后,反应速率(v)变化如图所示,该反应是( )
的命名正确的是( ) A、3-甲基庚烷 B、2-乙基己烷 C、1-甲基-4-乙基戊烷 D、1, 4-二甲基己烷12. 能够确定溶液中一定含有SO42-的是( )A、取样,加入用盐酸酸化的氯化钡溶液,有白色沉淀生成 B、取样,加入氯化钡溶液,有白色沉淀生成,再加稀硝酸沉淀不消失 C、取样,加入硝酸钡溶液,有白色沉淀生成 D、取样,加入盐酸无现象,再加氯化钡溶液,有白色沉淀生成13. 已达到平衡的可逆反应,增大压强后,反应速率(v)变化如图所示,该反应是( ) A、N2(g)+3H2(g) ⇌ 2NH3(g) B、C(s)+H2O(g) ⇌ CO2(g)+H2(g) C、H2(g)+I2(g) ⇌ 2HI(g) D、FeCl3+3KSCN ⇌ Fe(SCN)3+3KCl14. 等体积混合pH=11的NaOH溶液和pH=3的CH3COOH溶液,所得溶液中c(Na+)、c(CH3COO- )的正确关系是( )A、c(Na+)> c(CH3COO-) B、c(Na+)< c(CH3COO-) C、c(Na+)= c(CH3COO-) D、不能确定15. 下列实验不用浓硫酸的是( )A、实验室制取乙烯 B、苯与混酸反应制硝基苯 C、乙酸与乙醇反应制取乙酸乙酯 D、乙酸乙酯在酸性条件下水解16. 如图所示电化学装置(碳棒作电极)的判断合理的是( )
A、N2(g)+3H2(g) ⇌ 2NH3(g) B、C(s)+H2O(g) ⇌ CO2(g)+H2(g) C、H2(g)+I2(g) ⇌ 2HI(g) D、FeCl3+3KSCN ⇌ Fe(SCN)3+3KCl14. 等体积混合pH=11的NaOH溶液和pH=3的CH3COOH溶液,所得溶液中c(Na+)、c(CH3COO- )的正确关系是( )A、c(Na+)> c(CH3COO-) B、c(Na+)< c(CH3COO-) C、c(Na+)= c(CH3COO-) D、不能确定15. 下列实验不用浓硫酸的是( )A、实验室制取乙烯 B、苯与混酸反应制硝基苯 C、乙酸与乙醇反应制取乙酸乙酯 D、乙酸乙酯在酸性条件下水解16. 如图所示电化学装置(碳棒作电极)的判断合理的是( ) A、若Z为氯化铜溶液,Y有暗红色物质析出 B、若Z为氯化铜溶液,X附近发生还原反应 C、若Z为饱和食盐水,则X是阴极 D、若Z为饱和食盐水,则碱在X附近先生成17. 关于侯氏制碱法,下列表述错误的是( )A、食盐利用率比较高 B、实验条件下NaHCO3的溶解度较小 C、析出NaHCO3固体后的母液中只含氯化铵 D、在饱和食盐水中应先通入氨气,再通入二氧化碳18. 为探究铁的性质进行图所示实验,下列描述正确的是( )
A、若Z为氯化铜溶液,Y有暗红色物质析出 B、若Z为氯化铜溶液,X附近发生还原反应 C、若Z为饱和食盐水,则X是阴极 D、若Z为饱和食盐水,则碱在X附近先生成17. 关于侯氏制碱法,下列表述错误的是( )A、食盐利用率比较高 B、实验条件下NaHCO3的溶解度较小 C、析出NaHCO3固体后的母液中只含氯化铵 D、在饱和食盐水中应先通入氨气,再通入二氧化碳18. 为探究铁的性质进行图所示实验,下列描述正确的是( ) A、①中溶液呈棕黄色 B、①中Fe被还原 C、②中一定没有Fe2+ D、②中的反应说明氧化性: Cl2> Fe3+19. 已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下:
A、①中溶液呈棕黄色 B、①中Fe被还原 C、②中一定没有Fe2+ D、②中的反应说明氧化性: Cl2> Fe3+19. 已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下:①H2(g)+ Cl2(g) → 2HCl(g)+Q1; ②H2(g) + Br2(g) → 2HBr(g)+Q2
下列叙述错误的是( )
A、Q1> Q2 B、①和②中生成物总能量均低于反应物总能量 C、若①中反应生成2mol液态氯化氢,放出的热量低于Q1 D、②中2mol HBr(g)分解为1molH2(g)与1 molBr2(g),吸收的热量为Q220. 某溶液中除了H+和OH-外,还有大量共存的Mg2+、Fe3+、Cl-且它们的物质的量浓度之比为1: 1: 6。下列叙述正确的是( )A、向该溶液中滴加NaOH溶液,立即产生沉淀 B、向该溶液中加入少量铁粉,c(Fe3+)一定减少 C、将该溶液蒸干并灼烧,得到FeCl3与MgCl2 D、若该溶液中c(Mg2+)=0.2mol▪L-1 , 则溶液的pH定为1二、解答题
-
21. 铝及其化合物在生产、生活中存在广泛用途。
完成下列填空:
(1)、铝原子的最外层电子排布式 , 该原子核外有种能量不同的电子。铝片放入冷浓硫酸片刻后插入硫酸铜溶液中,发现铝片表面无明显变化,其原因是。除去铁粉中含有少量铝,通常选溶液。(2)、在一定条件下,氮化铝可通过如下反应制得:Al2O3(s)+ N2(g) + 3C(s) ⇌ 2AlN(s) +3CO(g).请给反应中第二周期元素的原子半径由大到小排序 (用元素符号表示)。写出该反应的平衡常数表达式。一定条件下,向充满氮气的2 L密闭容器中加入氧化铝和炭黑,2 min后固体质量减轻56 g,计算氮气的反应速率。(3)、某工业废水Al3+超标,加入NaHCO3溶液可以除去Al3+ , 现象为产生白色沉淀和无色无味的气体。请从平衡移动角度解释这现象。22. 生活污水中氮是造成水体富营养化的主要原因。完成下列填空:
(1)、某污水中存在NH4Cl。写出NH4Cl的电子式。该污水呈现酸性的原因 (结合离子方程式及相关文字说明)。(2)、向饱和NH4Cl溶液中加入或通入一种物质,可以使NH4Cl结晶析出,这种物质可以是 (任写-种),理由是。(3)、某污水中同时存在NH4+和NO3-时,可用下列方法除去:先利用O2将NH4+氧化成NO3-。请配平下列离子方程式并标出电子转移的方向和数目。 NH4++O2→ NO3-+ H2O+ H+; , 再将NO3-还原成N2 , 反应的离子方程式:2NO3-+5H2 N2+2 O H-+4H2O①NH4NO3晶体中所含化学键为。
② 若该污水中含有1mol NH4NO3 , 用以上方法处理完全后,共消耗mol氢气。
③ 该污水处理方法的好处是。
三、综合题
-
23. 环扁桃酯临床上主要用于治疗脑动脉硬化。环扁桃酯在一定条件下的合成路线如下所示:
 (1)、写出C中含氧官能团的名称、 , A→C的反应类型。(2)、写出两分子C生成的环状酯类化合物的反应条件 , 该环状酯类化合物的结构简式 。(3)、写出与B互为同分异构体的有机物结构简式。(4)、写出反应②的化学反应方程式。(5)、已知CH3COOH ClCH2COOH,请完成由乙醇合成B的路线。
(1)、写出C中含氧官能团的名称、 , A→C的反应类型。(2)、写出两分子C生成的环状酯类化合物的反应条件 , 该环状酯类化合物的结构简式 。(3)、写出与B互为同分异构体的有机物结构简式。(4)、写出反应②的化学反应方程式。(5)、已知CH3COOH ClCH2COOH,请完成由乙醇合成B的路线。(合成路线常用的表示方式为:A B ... ... 目标产物)