上海市崇明区2018-2019学年高考化学一模(期末)考试试卷
试卷更新日期:2019-04-15 类型:高考模拟
一、单选题
-
1. 市售84消毒液,外观无色透明,具有优良的消毒杀菌作用,保质期长。其有效成分是( )A、Cl2 B、NaClO C、SO2 D、KMnO42. 下列化学概念之间存在绝对界限的是( )A、混合物和纯净物 B、有机物和无机物 C、浓溶液和稀溶液 D、被氧化和被还原3. 下列变化过程与酒精挥发的本质相同的为( )A、氯化氢溶于水 B、固体碘升化 C、氯化铵热分解 D、石英砂熔化4. 补钙是人类保健的热点,人体需要摄入一定量钙元素。关于钙离子与钙原子的比较正确的是( )A、质量Ca2+比Ca大 B、半径Ca2+比Ca大 C、电子Ca2+比Ca少 D、质子Ca2+比Ca少5. 工业制硫酸和合成氨生产中相同的是( )A、所有原料气都循环使用 B、都用压缩机压缩原料气 C、用了完全相同的催化剂 D、都用热交换器进行加热6. 已知硫化氢分子中只存在一种共价键,且是极性分子。则( )A、它不可能是直线型分子 B、它有可能是直线型分子 C、它有可能是离子化合物 D、它不可能是共价化合物7. 氢氧化钠溶于水时( )A、水合过程大于扩散过程 B、扩散过程大于水合过程 C、扩散过程放出的热量大于水合过程吸收的热量 D、水合过程放出的热量大于扩散过程吸收的热量8. 碳原子数为2和3的饱和一元醇相比较( )A、都存在类别异构 B、互为同分异构体 C、都存在位置异构 D、都可被氧化为醛9. 在化学反应中一定发生变化的是( )A、各元素的化合价 B、物质总物质的量 C、物质的总质量 D、物质中的化学键10. 常温下,下列各溶液中水的电离度最大的是( )A、pH=1的硫酸溶液 B、c(H+)=10-10mol/L纯碱溶液 C、0.01mol/L的烧碱溶液 D、c(H+ )=10-5mol/L的硫铵溶液11. 与下图相符合的是( )
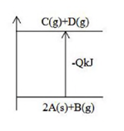 A、2A(s)+B(g) →C(g)+D(g)-QkJ B、C(g)+D(g)→2A(s)+B(g)+QkJ C、2g固体A与1g气体B反应生成lgC气体和lgD气体吸收QkJ热量 D、2摩尔固体A与1摩尔B气体反应吸收QkJ热量12. 在一定条件下,铁与有关物质的反应,所得产物错误的为( )A、Fe FeCl3 B、Fe FeS C、Fe Fe(OH)3 D、Fe Fe3O413. 如图所示,两个装管都是将铁棒和石墨棒插入滴有酚酞的饱和食盐水中。一段时间后( )
A、2A(s)+B(g) →C(g)+D(g)-QkJ B、C(g)+D(g)→2A(s)+B(g)+QkJ C、2g固体A与1g气体B反应生成lgC气体和lgD气体吸收QkJ热量 D、2摩尔固体A与1摩尔B气体反应吸收QkJ热量12. 在一定条件下,铁与有关物质的反应,所得产物错误的为( )A、Fe FeCl3 B、Fe FeS C、Fe Fe(OH)3 D、Fe Fe3O413. 如图所示,两个装管都是将铁棒和石墨棒插入滴有酚酞的饱和食盐水中。一段时间后( ) A、两装置中铁棒都被氧化而减少 B、两装置中产生的气体体积相同 C、两装置中碳棒质量都保持不变 D、两装置中铁棒旁溶液都先变红14. 某有机物的结构
A、两装置中铁棒都被氧化而减少 B、两装置中产生的气体体积相同 C、两装置中碳棒质量都保持不变 D、两装置中铁棒旁溶液都先变红14. 某有机物的结构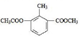 ,关于该物质的叙述错误的是( ) A、能使酸性KMnO4溶液褪色 B、苯环上的一取代物有2种 C、一定条件下可以发生水解 D、一个分子含有12个氢原子15. 为了除尽NaCl中所含杂质MgCl2、CaCl2和Na2SO4 , 先后向溶液中加入稍过量的NaOH、BaCl2和NaCO3 , 去除沉淀后再用盐酸调节pH=7。下列加入该三种试剂的先后顺序错误的是( )A、NaOH、BaCl2、 Na2CO3 B、BaCl2、Na2CO3、 NaOH C、NaOH、Na2CO3、BaCl2 D、BaCl2、NaOH、Na2CO316. 下列有关实验中的基本操作正确的是( )A、胶头滴管插入滴瓶后,要再挤一下胶头使溶液进入滴管中 B、插入橡皮导管的玻璃导管一端蘸水,然后再边旋转边插入 C、容量瓶内装水,塞上塞子倒转不漏水即说明该容量瓶可用 D、分液漏斗中下层液体放出后,换一个接液烧杯放上层液体17. 一定条件下发生的下列四个化学反应中,酸所显示的性质与其他三个有所不同的是( )A、Ag+2HNO3→AgNO3+NO2↑+H2O B、3Fe3O4+28HNO3→9Fe(NO3)3+NO↑+14H2O C、H2S+H2SO4→S↓+SO2↑+2H2O D、Cu+2H2SO4→CuSO4+SO2↑+2H2O18. 下列化学反应不宜作为工业冶炼金属的原理的是( )A、2NaCl(熔融) 2Na+Cl2↑ B、Al2O3+3C 2Al+3CO↑ C、Fe2O3+3CO 2Fe+3CO2 D、HgS+O2 Hg+SO219. 在95%的乙醇溶液中加入生石灰蒸馏可制得无水乙醇。除去下列物质中少量杂质(写在括号内)采用的方法与制取无水乙醇的方法相同的是( )A、己烷(己烯) B、甲苯(苯) C、溴苯(溴) D、乙醇(乙酸)20. 某未知溶液中可能含有Cl-、SO42-、CO32-、Mg2+、Al3+和Na+ , 取一定量该溶液进行实验,过程记录如下:( )
,关于该物质的叙述错误的是( ) A、能使酸性KMnO4溶液褪色 B、苯环上的一取代物有2种 C、一定条件下可以发生水解 D、一个分子含有12个氢原子15. 为了除尽NaCl中所含杂质MgCl2、CaCl2和Na2SO4 , 先后向溶液中加入稍过量的NaOH、BaCl2和NaCO3 , 去除沉淀后再用盐酸调节pH=7。下列加入该三种试剂的先后顺序错误的是( )A、NaOH、BaCl2、 Na2CO3 B、BaCl2、Na2CO3、 NaOH C、NaOH、Na2CO3、BaCl2 D、BaCl2、NaOH、Na2CO316. 下列有关实验中的基本操作正确的是( )A、胶头滴管插入滴瓶后,要再挤一下胶头使溶液进入滴管中 B、插入橡皮导管的玻璃导管一端蘸水,然后再边旋转边插入 C、容量瓶内装水,塞上塞子倒转不漏水即说明该容量瓶可用 D、分液漏斗中下层液体放出后,换一个接液烧杯放上层液体17. 一定条件下发生的下列四个化学反应中,酸所显示的性质与其他三个有所不同的是( )A、Ag+2HNO3→AgNO3+NO2↑+H2O B、3Fe3O4+28HNO3→9Fe(NO3)3+NO↑+14H2O C、H2S+H2SO4→S↓+SO2↑+2H2O D、Cu+2H2SO4→CuSO4+SO2↑+2H2O18. 下列化学反应不宜作为工业冶炼金属的原理的是( )A、2NaCl(熔融) 2Na+Cl2↑ B、Al2O3+3C 2Al+3CO↑ C、Fe2O3+3CO 2Fe+3CO2 D、HgS+O2 Hg+SO219. 在95%的乙醇溶液中加入生石灰蒸馏可制得无水乙醇。除去下列物质中少量杂质(写在括号内)采用的方法与制取无水乙醇的方法相同的是( )A、己烷(己烯) B、甲苯(苯) C、溴苯(溴) D、乙醇(乙酸)20. 某未知溶液中可能含有Cl-、SO42-、CO32-、Mg2+、Al3+和Na+ , 取一定量该溶液进行实验,过程记录如下:( )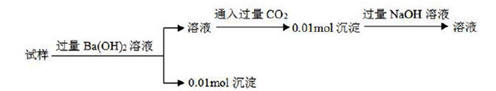 A、一定有Cl- B、一定有CO32- C、一定没有Na+ D、一定没有Mg2+
A、一定有Cl- B、一定有CO32- C、一定没有Na+ D、一定没有Mg2+二、综合题
-
21. 以硼砂、萤石和浓硫酸为原料可制取有机合成的原料三氟化硼。
反应原理为B2O3(S)+3CaF2(S)+3H2SO4(浓)⇌2BF3(g)+3CaSO4(S)+3H2O(l)。
请完成下列填空:
(1)、写出萤石的电子式 , 已知BF3为非极性分子,则其分子构型可能为(选填编号)。A.三角锥形
B.平面正三角形
C.直线形
D.正四面体形
(2)、试写出硼原子的最外层电子排布式 , 硼原子核外有种不同形状的电子云。(3)、除硼元素外的其他短周期元素的简单离子的半径由小到大排列的是(用离子符号表示)。有些元素在元素周期表中相邻,能比较它们的金属性和非金属性强弱的有(选填编号)。A.相互之间的置换反应
B.最高价氧化物对应的水化物的酸性
C.氢化物水溶液的酸性
D.相互形成的化合物中元素的化合价
实验室中在8L的密闭容器中进行该反应。
(4)、已知该反应的化学平衡常数表达式K=[BF3]2 , 下列措施能缩短反应达到平衡的时间的有_________(选填编号)。A、增大硫酸的浓度 B、缩小反应容器体积 C、投入更多的萤石 D、升高反应炉内温度(5)、此反应达到平衡后,压缩容器体积,在平衡移动的过程中逆反应速率的变化情况是。一定条件下,经5min达到平衡,容器中液态物质减少24g,用气体生成物来表示该反应的速率为。三、填空题
-
22. 若把黄铜矿CuFeS2看作为硫化铜和硫化亚铁的缔合物,可用来制取铜和铁及硫的化合物。如:8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2(1)、在黄铜矿中硫的化合价为 , 该反应中还原产物(通过得电子而产生的物质)有种。(2)、若反应中消耗氧气6.3mol,则反应转移的电子数为 , 其中某元素部分被氧化,则其被氧化和未被氧化的物质的量之比为。(3)、反应产生污染气体,需要吸收处理,下列不可用来吸收该污染气体的是_________(选填编号)A、KMnO4溶液 B、NaOH溶液 C、H2S气体 D、NaHSO3溶液(4)、某吸收方法产生的物质可能有:①Na2SO4②NaHSO4③Na2SO3④NaHSO3等。
等浓度的上述四种物质的溶液pH值由大到小的是(用编号填写),选用这些物质中的部分,实现离子反应2H++SO32-→H2O+SO2↑,写出对应的化学方程式。某NaHSO3的浓度为c1 , pH为x1 , NaHSO4溶液的浓度为c2 , pH为x2 , 若x1<x2 , 则c1c2(填“>”或“<“或“=”)。
四、实验题
-
23. 新型浄水剤PAC的化学式为Al(OH)xCly∙zH2O,它的一般生产工艺流程如下:
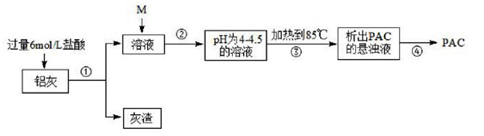 (1)、用36.5% (p为1.1 8g/cm3)的盐酸配制500mL6mo/L的盐酸,所用玻璃器有烧杯、量筒(量取一定体积浓盐酸)、玻璃棒、 , 操作②是测定溶液的pH值,控制pH值在一定范围的目的是。(2)、操作③使用的是方法,④的具体操作为。(3)、为测定PAC化学式中的x、y、z的值。
(1)、用36.5% (p为1.1 8g/cm3)的盐酸配制500mL6mo/L的盐酸,所用玻璃器有烧杯、量筒(量取一定体积浓盐酸)、玻璃棒、 , 操作②是测定溶液的pH值,控制pH值在一定范围的目的是。(2)、操作③使用的是方法,④的具体操作为。(3)、为测定PAC化学式中的x、y、z的值。①取样品研碎置于(填仪器名称) 中加热灼烧到质量不再減少, 26.5g 样品最终变为白色粉末10.2g。实验过程中至少进行的称量次数为。
②另取相同质量的样品溶于中,加入足量硝酸银溶液取得沉淀,经洗涤、烘干、称量为28.7g,实验中检查沉淀是否洗浄的方法是。
③列式汁算:x+y=3, =
请写出另一条比例式为。
-
-