2017年高考化学押题预测卷(新课标Ⅰ卷)
试卷更新日期:2017-05-09 类型:高考模拟
一、选择题
-
1. 化学与生活密切相关。下列说法错误的是( )A、油脂是产生能量最高的营养物质 B、为使水果尽快成熟,需要用浸泡过高锰酸钾溶液的硅土吸收水果产生的乙烯 C、减少化石燃料燃烧和汽车尾气排放,是减少雾霾发生的有效措施 D、CO2合成可降解的聚碳酸酯类塑料,实现“碳循环”,可有效减少“白色污染”2. 设NA表示阿伏加德罗常数的值,下列判断正确的是( )A、常温下,pH=1的盐酸溶液中,由水电离的H+个数为10-13NA B、标准状况下,氧原子总数为0.2NA的CO2和NO2的混合气体,其体积为2.24L C、常温下,5.6g铁分别与足量氯气和浓硝酸反应,转移的电子数目均为0.3NA D、100g46%乙醇溶液中所含O-H数目为7NA3.
自然界中的许多植物中含有醛,其中有些具有特殊香味,可作为植物香料使用,例如桂皮含肉桂醛(
 ),杏仁含苯甲醛(
),杏仁含苯甲醛(  )。下列说法错误的是( )A、肉桂醛能发生加成反应、取代反应和加聚反应 B、可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团 C、肉桂醛和苯甲醛互为同系物 D、苯甲醛分子中所有原子可能位于同一平面内4. W、X、Y、Z是原子序数依次增大的短周期主族元素。已知W原子的最外层电子数是电子层数的2倍,Y原子次外层电子数与其他各层电子总数相等,W和X的原子序数之和等于Z的原子序数。下列说法正确的是( )A、含氧酸的酸性:Z>W B、简单离子半径:X>Y>Z C、四种元素均能与氢元素形成共价键 D、在一定条件下W的单质能与Y的最高价氧化物对应的水化物反应5.
)。下列说法错误的是( )A、肉桂醛能发生加成反应、取代反应和加聚反应 B、可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团 C、肉桂醛和苯甲醛互为同系物 D、苯甲醛分子中所有原子可能位于同一平面内4. W、X、Y、Z是原子序数依次增大的短周期主族元素。已知W原子的最外层电子数是电子层数的2倍,Y原子次外层电子数与其他各层电子总数相等,W和X的原子序数之和等于Z的原子序数。下列说法正确的是( )A、含氧酸的酸性:Z>W B、简单离子半径:X>Y>Z C、四种元素均能与氢元素形成共价键 D、在一定条件下W的单质能与Y的最高价氧化物对应的水化物反应5.利用如图所示装置进行下列实验,将X溶液逐滴加入固体Y中,下列关于试管中的现象描述不正确的是( )

选项
X溶液
固体Y
Z溶液
现象
A
稀硫酸
Na2O2
氢硫酸
产生淡黄色沉淀
B
浓氨水
碱石灰
氯化铝溶液
产生白色沉淀
C
浓硝酸
Cu
硅酸钠溶液
产生白色沉淀
D
稀盐酸
CaCO3
氯化钡溶液
产生白色沉淀
A、A B、B C、C D、D6.磷酸铁锂电池具有高效率输出、可快速充电、对环境无污染等优点,其工作原理如图。M电极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种
能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式
为LixC6+Li1-xFePO4
 LiFePO4+6C。下列说法正确的是( )
LiFePO4+6C。下列说法正确的是( ) A、放电时Li+从右边移向左边 B、放电时M是负极,电极反应式为:C6x--xe-=6C C、充电时N极连接电源的正极,电极反应式为:LiFePO4-xe-=Li1-xFePO4+xLi+ D、充电时电路中通过0.5mol电子,消耗36gC7. 25℃时,将amol/L、pH=m的一元酸HX溶液与bmol/L、pH=n的NaOH溶液等体积混合后pH>7。下列说法正确的是( )A、若a=b,则HX一定是弱酸 B、反应后溶液中一定存在c(Na+)>c(X-)>c(OH-)>c(H+) C、若a=b,则m+n<14 D、若a=2b,则反应后溶液中一定存在2c(OH-)=c(HX)+2c(H+)
A、放电时Li+从右边移向左边 B、放电时M是负极,电极反应式为:C6x--xe-=6C C、充电时N极连接电源的正极,电极反应式为:LiFePO4-xe-=Li1-xFePO4+xLi+ D、充电时电路中通过0.5mol电子,消耗36gC7. 25℃时,将amol/L、pH=m的一元酸HX溶液与bmol/L、pH=n的NaOH溶液等体积混合后pH>7。下列说法正确的是( )A、若a=b,则HX一定是弱酸 B、反应后溶液中一定存在c(Na+)>c(X-)>c(OH-)>c(H+) C、若a=b,则m+n<14 D、若a=2b,则反应后溶液中一定存在2c(OH-)=c(HX)+2c(H+)二、非选择题
-
8.
硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如下图所示:

已知:① SO2(g)+Cl2(g)
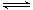 SO2Cl2(l) ΔH=-97kJ/mol;
SO2Cl2(l) ΔH=-97kJ/mol;② 硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;
③ 100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
回答下列问题:
(1)、硫酰氯在潮湿空气中“发烟”的原因是(用化学方程式表示)。(2)、检验装置G气密性的方法是。(3)、装置A中发生反应的离子方程式为。(4)、H的作用是 , 其中水流的方向是→(填a或b)。(5)、装置C、F中的试剂相同,盛放的试剂为。(6)、该装置存在的一处缺陷是。(7)、若将SO2、Cl2按照一定比例通入水中,请设计简单实验验证二者是否恰好完全反应(简要描述实验步骤、现象和结论):。仪器自选;供选择试剂:滴加酚酞的氢氧化钠溶液、氯化亚铁溶液、硫氰化钾溶液、品红溶液。
9.重铬酸钠在制革工业、印刷工业、电镀工业等有重要用途,铬铁矿的主要成分可表示为FeO•Cr2O3 , 还含有Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钠(Na2Cr2O7)的流程图:
 (1)、煅烧前应将铬铁矿充分粉碎,其目的是。灼烧是中学化学中常用的操作方法,如在实验室中将铬铁矿和碳酸钠固体混合物灼烧,以下各实验仪器中不需要的是。
(1)、煅烧前应将铬铁矿充分粉碎,其目的是。灼烧是中学化学中常用的操作方法,如在实验室中将铬铁矿和碳酸钠固体混合物灼烧,以下各实验仪器中不需要的是。a.陶瓷坩埚 b.铁坩埚 c.三脚架 d.泥三角
(2)、转窑中发生的主要反应为:
①Na2CO3+Al2O3
 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;② FeO•Cr2O3+ Na2CO3+ O2
 Na2CrO4+ Fe2O3+ 。
Na2CrO4+ Fe2O3+ 。请配平反应②的化学方程式。
(3)、生成固体Y的离子方程式为。(4)、向母液中加入浓硫酸,把铬酸钠转化为重铬酸钠,经两次蒸发,主要是除去(填化学式),冷却至30~40℃得到产品晶体。洗涤该晶体的溶剂最好是(填序号)。a.蒸馏水 b.无水乙醇 c.75%乙醇溶液
(5)、为了测定实验制得的产品中Na2Cr2O7的含量,称取样品0.140g置于锥形瓶中,加50mL水;再加入2gKI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10min;然后加150mL蒸馏水并加入3mL 0.5%淀粉溶液;用0.1000mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00mL。(假定杂质不参加反应,已知:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,I2+2S2O32-=2I-+S4O62-)①终点实验现象是。
②该产品中Na2Cr2O7的纯度为。(以质量分数表示)
③若滴定管在滴定前俯视读数,滴定结束后仰视读数,测得样品的纯度将(填“偏高”、或“偏低”或“无影响”)。
10.甲醇是重要的化工原料,又可作为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)
 CH3OH(g) ΔH1
CH3OH(g) ΔH1②CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
CH3OH(g)+H2O(g) ΔH=-58 kJ/mol③CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=+41 kJ/mol
CO(g)+H2O(g) ΔH=+41 kJ/mol回答下列问题:
(1)、已知反应①中相关的化学键键能数据如下:
化学键
H-H
C-O
C
 O
OH-O
C-H
E/(kJ·mol-1)
436
343
1076
465
x
则x=。
(2)、若将1mol CO2和2mol H2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应②。测得CH3OH的物质的量随时间的变化如图所示。

①曲线I、Ⅱ对应的平衡常数大小关系为KIKⅡ(填“>”或“=”或“<”);
②一定温度下,能判断该反应达到化学平衡状态的是。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=O断裂的同时有6个H—H断裂
③若5min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率为 , 该温度下的平衡常数为;若容器容积不变,下列措施可增加甲醇产率的是。
a.缩小反应容器的容积 b.使用合适的催化剂
c.充入He d.按原比例再充入CO2和H2
(3)、以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池。以此电池作电源,在实验室中模拟铝制品表面“钝化”处理过程(装置如图所示)。其中物质b是 , 阳极电极反应为。

三、选修题
-
11.
[化学——选修3:物质结构与性质]
“摩尔盐”是分析化学中的重要试剂,化学式为(NH4)2Fe(SO4)2·6H2O。“摩尔盐”在一定条件下分解的方程式为:4[(NH4)2Fe(SO4)2·6H2O]
 2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+31H2O。回答下列问题:(1)、铁元素在元素周期表中的位置为 , 其价层电子排布图为。(2)、组成“摩尔盐”的非金属元素中第一电离能最大的元素为。“摩尔盐”的分解产物中属于非极性分子的化合物是。(3)、NH3的沸点比N2O的沸点(填“高”或“低”),其主要原因是。(4)、K3[Fe(CN)6]常用于检验Fe2+ , K3[Fe(CN)6]中除了离子键以外还存在的化学键为 , 与CN—互为等电子体的单质的分子式为_。HCN分子中σ键和π键的个数之比为。(5)、
2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+31H2O。回答下列问题:(1)、铁元素在元素周期表中的位置为 , 其价层电子排布图为。(2)、组成“摩尔盐”的非金属元素中第一电离能最大的元素为。“摩尔盐”的分解产物中属于非极性分子的化合物是。(3)、NH3的沸点比N2O的沸点(填“高”或“低”),其主要原因是。(4)、K3[Fe(CN)6]常用于检验Fe2+ , K3[Fe(CN)6]中除了离子键以外还存在的化学键为 , 与CN—互为等电子体的单质的分子式为_。HCN分子中σ键和π键的个数之比为。(5)、FeO晶胞结构如下图所示,FeO晶体中Fe2+配位数为 , 若该晶胞边长为acm,则该晶胞密度为。
 12.
12.[化学——选修5:有机化学基础]
某化学兴趣小组以苯的同系物D和乙烯为主要原料,采用以下路线合成药物M(
 ):
):
已知:①相同条件下D蒸气的密度是氢气的46倍;
②
 ;
;③
 。
。请回答下列问题:
(1)、对于化合物M,下列说法正确的是(填序号)。a.可与浓盐酸形成盐 b.不能与氢气发生加成反应
c.可发生水解反应 d.属于两性化合物
(2)、A的结构简式为 , D的名称是。(3)、合成路线中属于氧化反应的有(填序号),E分子中官能团名称为。(4)、写出C+F→G的化学反应方程式。(5)、E的某种同系物H,相对分子质量比E大14,符合下列条件的H的同分异构体的数目有种。①属于芳香族化合物;②含有-NH2;③能与NaHCO3溶液反应放出气体。
其中分子中核磁共振氢谱有6个吸收峰,且峰面积之比为1∶1∶1∶2∶2∶2的有机物结构简式为_。
(6)、已知反应②的原子利用率是100%,通常采用乙烯为原料制得A后与B反应合成C,请用化学反应方程式表示以乙烯为原料制备B的合成路线(无机试剂任选)。