2019年初中化学中考难点专练 16 无机化工流程
试卷更新日期:2019-04-11 类型:二轮复习
一、综合题
-
1. 明矾[ KAl(SO4)2·12H2O ]在造纸、净水等方面应用广泛。以处理过的废旧易拉罐碎屑为原料(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。

回答下列问题:
(1)、原料溶解过程中反应的离子方程式是。(2)、Al(OH)3 与稀硫酸反应的离子方程式是。(3)、溶液A中通入过量CO2 , 反应的离子方程式是。(4)、为证明固体B中含有铁,某同学做如下实验:取少量固体B,加入稀硫酸使其溶解,观察到有无色气体生成。向溶液中加入 , 溶液立即变红,证明固体B中含有铁。2. 电子工业中,常用FeCl3溶液腐蚀绝缘板上的铜箔,制造印刷电路板。某同学为了从腐蚀废液中回收铜,并重新获得FeCl3溶液,设计如下流程图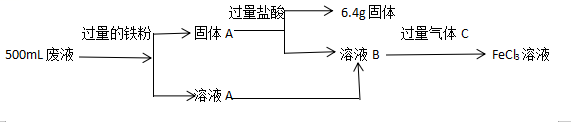
请回答下列问题:
(1)、FeCl3溶液腐蚀铜箔反应的离子方程式为。(2)、固体A的成分是 , 气体C的化学式为。(3)、设计实验方案证明FeCl3溶液中的金属阳离子。(4)、反应消耗铁粉11.2g,则废液中Fe3+的物质的量浓度是。3.(1)、(一)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L 的溶液。在FeCl2溶液中需加入少量铁屑,用离子方程式解释其目的。
(2)、甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为。(3)、乙组同学认为甲组的实验不够严谨,请你代表乙组发表改进方案。(4)、(二)工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO、SiO2等)制备绿矾FeSO4·7H2O的流程如下: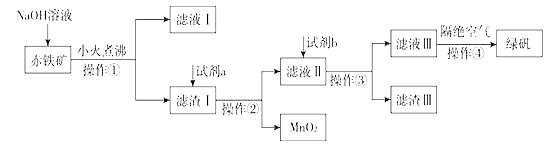
氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为。
(5)、向滤渣Ⅰ中加入过量的试剂a为 , 加入过量试剂b后所得滤渣Ⅲ的主要成分为。(6)、操作③需要的玻璃仪器主要包括。(7)、操作④需要隔绝空气的主要原因可能是什么?。4. 海水是自然赐给人类的宝藏,海水的综合利用是全世界研究的重点。完成下列问题:(1)、粗盐中除了含有泥沙之外还含有Ca2+、Mg2+、SO42-等杂质,粗盐获得精盐一般步骤如下:
加入的试剂①、②分别是:、。
(2)、某学生在实验室中模拟海水提取溴的步骤为:
取25 L除去悬浮杂质后的海水,浓缩至2L,向其中通入足量氯气。
①氧化步骤中生成Br2的离子方程式为。
②将吹出的Br2(g)用纯碱溶液全部吸收,发生反应:3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑,产生的CO2通入足量澄清石灰水中,得到1g白色沉淀。计算海水中溴的浓度为g/L。
③实验室中若用CCl4提取少量的溴:向溴水中加入CCl4振荡、静置……得溴的四氯化碳溶液,该分离提纯溴的方法叫;用到的主要仪器为。
(3)、实验证明金属制品在海水中更容易生锈,铜锈的化学式为: 。5.(1)、Ⅰ.铝土矿(主要成分为Al2O3 , 还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
沉淀A的成分是(填化学式)。
(2)、步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH﹣=H2O外,还有:、;
(3)、步骤③中加入(或通入)的过量试剂b是。(4)、Ⅱ.利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
从硫元素化合价的角度分析,图中既有氧化性又有还原性的化合物有(填化学式)。
(5)、将X与Y混合,可生成淡黄色固体,该反应的化学方程式为。(6)、Na2S2O3是重要的化工原料,从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是(填代号).a.Na2S+S
b.Na2SO3+S
c.SO2+Na2SO4
d.Na2SO3+Na2SO4
6. NH3和HNO3是重要的工业产品,下图为合成氨以及氨氧化制硝酸的流程。 (1)、N2约占空气体积的 , 从空气中分离出N2利用的原理是。(2)、合成塔中发生反应的化学方程式是 , 该反应中的氧化剂是。22.4LN2(标准状况)完全反应时,转移电子的物质的量是。(3)、氧化炉中发生反应的化学方程式是。(4)、吸收塔中通入空气的作用是。7.
(1)、N2约占空气体积的 , 从空气中分离出N2利用的原理是。(2)、合成塔中发生反应的化学方程式是 , 该反应中的氧化剂是。22.4LN2(标准状况)完全反应时,转移电子的物质的量是。(3)、氧化炉中发生反应的化学方程式是。(4)、吸收塔中通入空气的作用是。7.以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:


氯化铵和硫酸钠的溶解度随温度变化如图所示.回答下列问题:
(1)、欲制备10.7g NH4Cl,理论上需NaCl g.(2)、实验室进行蒸发浓缩用到的主要仪器有 、烧杯、玻璃棒、酒精灯等.(3)、“冷却结晶”过程中,析出NH4Cl晶体的合适温度为 .(4)、不用其它试剂,检查NH4Cl产品是否纯净的方法及操作是(5)、若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是8.氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下
 (1)、粗盐中含CaCl2、MgCl2等杂质,写出精制过程中发生反应的化学方程式是 , .(2)、如果粗盐中SO42﹣含量较高,必须添加钡式剂除去SO42﹣ , 该钡试剂可以是A、Ba(OH)2 B、Ba(NO3)2 C、BaCl2(3)、电解过程中所发生反应的化学方程式为 , 与电源正极相连的电极附近产生的气体是 , 检验该气体可使用试纸,现象是试纸变为色.(4)、
(1)、粗盐中含CaCl2、MgCl2等杂质,写出精制过程中发生反应的化学方程式是 , .(2)、如果粗盐中SO42﹣含量较高,必须添加钡式剂除去SO42﹣ , 该钡试剂可以是A、Ba(OH)2 B、Ba(NO3)2 C、BaCl2(3)、电解过程中所发生反应的化学方程式为 , 与电源正极相连的电极附近产生的气体是 , 检验该气体可使用试纸,现象是试纸变为色.(4)、氯碱工厂生产的氯气和氢气可以进一步用于生产盐酸,主要过程如下:

其中关键的一步为氯气和氢气在燃烧管口燃烧生成HCl,氯气有毒,应采取的措施是 . 合成盐酸厂要求合成气中的HCl的含量要大于97%,试用最简便的方法进行分析是否含量大于97% .
(5)、氯碱工厂生产的氯气和氢氧化钠溶液可以用于制取“84消毒液”,反应的化学方程式为 .(6)、某同学欲证明盐酸与氯化氢气体性质不同,他分别向A、B、C三支洁净试管中各放入一片干燥的蓝色石蕊试纸,然后往A试管内加入盐酸,试纸显色,往B试管中通入干燥的氯化氢气体,试纸显色.最后向C试管中加入物质(填化学式),他之所以加入这种物质的理由是 .9. 我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了突出的贡献.如图是某厂应用“侯氏制碱法”生产纯碱的工艺流程图,据图回答: (1)、上述流程图中,可循环利用的物质是;(2)、流程Ⅰ后过滤所得滤液中含有的溶质有 .(3)、流程Ⅱ先通入氨气,再通入二氧化碳.如果反过来,二氧化碳的吸收率会降低.这是因为 .(4)、用一个化学反应方程式表示出流程Ⅱ中发生的总反应 .(5)、工业生产纯碱的流程中,碳酸化时溶液中析出碳酸氢钠而没有析出氯化铵的原因是 .10. 煤燃烧产生的粉煤灰(主要含有SiO2、Fe2O3、Al2O3等)是火电厂产生的废渣,若不加处理会污染环境。为综合利用,研究人员对其进行如下处理:
(1)、上述流程图中,可循环利用的物质是;(2)、流程Ⅰ后过滤所得滤液中含有的溶质有 .(3)、流程Ⅱ先通入氨气,再通入二氧化碳.如果反过来,二氧化碳的吸收率会降低.这是因为 .(4)、用一个化学反应方程式表示出流程Ⅱ中发生的总反应 .(5)、工业生产纯碱的流程中,碳酸化时溶液中析出碳酸氢钠而没有析出氯化铵的原因是 .10. 煤燃烧产生的粉煤灰(主要含有SiO2、Fe2O3、Al2O3等)是火电厂产生的废渣,若不加处理会污染环境。为综合利用,研究人员对其进行如下处理: (1)、滤渣主要成分是;滤液①中的阳离子为。(2)、滤液①中还加入还原剂原因是;若加入的还原剂为铁粉,反应的离子方程式为。(3)、加入氨水是为了调节pH使铝离子沉淀,其离子方程式为;反应终点的pH对铝和铁分离效果的影响如右图。根据实验结果,为达到好的分离效果,反应过程中控制pH的范围是 , 选择该范围的理由是。
(1)、滤渣主要成分是;滤液①中的阳离子为。(2)、滤液①中还加入还原剂原因是;若加入的还原剂为铁粉,反应的离子方程式为。(3)、加入氨水是为了调节pH使铝离子沉淀,其离子方程式为;反应终点的pH对铝和铁分离效果的影响如右图。根据实验结果,为达到好的分离效果,反应过程中控制pH的范围是 , 选择该范围的理由是。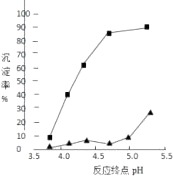 (4)、NH4HSO4和H2SO4按物质的量比1:1混合溶于水配制成浸取液,220℃时可将高铝粉煤灰中Al2O3转化为硫酸铝铵[NH4Al(SO4) 2],然后分离、煅烧获得纯Al2O3。
(4)、NH4HSO4和H2SO4按物质的量比1:1混合溶于水配制成浸取液,220℃时可将高铝粉煤灰中Al2O3转化为硫酸铝铵[NH4Al(SO4) 2],然后分离、煅烧获得纯Al2O3。查阅资料知硫酸铝铵:①溶解度:0℃时,S=5.2g;100℃时,S=421.9g 。②280℃时分解。
①依据资料可知,将硫酸铝铵与其他溶质分离的方法是。
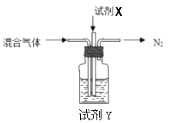
②煅烧NH4Al(SO4) 2时发生4NH4Al(SO4)2 2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑,得到混合气体(NH3、N2、SO2、SO3、H2O )。若16mol混合气体按如下装置被完全吸收制得浸取液。则右下图中,试剂X是(填化学式);试剂Y是(填名称),其中溶质的物质的量为。
 11. 从银精矿(其化学成分有:Ag、Zn、Cu、Pb、S及SiO2等)中提取银及铜和铅工艺流程如图:
11. 从银精矿(其化学成分有:Ag、Zn、Cu、Pb、S及SiO2等)中提取银及铜和铅工艺流程如图: (1)、步骤①当盐酸的浓度和KCO3的量一定时,为提高浸取率可采取的措施是、(问题中要求举两项)。(2)、步骤②试剂X为 , 步骤④滤渣中除含单质硫外,还含有的成分有。(3)、步骤③反应的化学方程式为。(4)、步骤⑤反应的离子方程式为。(5)、“粗银”(含Ag、Cu、Zn、Au)可用立式电解槽电解精炼,纯银作阴极,电解液采用硝酸和硝酸银的混合溶液。硝酸浓度不能过大,其原因是。(6)、此类工厂排出的废水中含有的NO3ˉ对人类健康造成危害。科技人员在碱性条件下用Al粉将NO3ˉ还原成N2。缺点是处理后的水中生成了AlO2ˉ,仍然对人袭健康有害。
(1)、步骤①当盐酸的浓度和KCO3的量一定时,为提高浸取率可采取的措施是、(问题中要求举两项)。(2)、步骤②试剂X为 , 步骤④滤渣中除含单质硫外,还含有的成分有。(3)、步骤③反应的化学方程式为。(4)、步骤⑤反应的离子方程式为。(5)、“粗银”(含Ag、Cu、Zn、Au)可用立式电解槽电解精炼,纯银作阴极,电解液采用硝酸和硝酸银的混合溶液。硝酸浓度不能过大,其原因是。(6)、此类工厂排出的废水中含有的NO3ˉ对人类健康造成危害。科技人员在碱性条件下用Al粉将NO3ˉ还原成N2。缺点是处理后的水中生成了AlO2ˉ,仍然对人袭健康有害。已知25℃,Ksp(Al(OH)3]=1.3×10-33 Al(OH)3 H++H2O+AlO2ˉ K=1.0×10-13
①25℃时,欲将上述处理过的水中的AlO2ˉ降到1.0×10-6mol/L,需调节溶液的pH= , 此时水中c(Al3+)=mol/L
②25℃时,Al(OH)3溶于NaOH溶液反应的平衡常数K=
12. FePO4是一种难溶于水、易溶于硫酸的固体,可用作金属防腐剂。实验室利用FeSO4.7H2O和H3PO4。(第一级电离常数Ka1=7.5×10-3)制备FePO4流程如下: (1)、“溶解”时H3PO4不宜过量太多的原因是。(2)、①写出“反应”时总反应的离子方程式:。
(1)、“溶解”时H3PO4不宜过量太多的原因是。(2)、①写出“反应”时总反应的离子方程式:。②证明“反应”后铁元素沉淀完全的实验方法是。
(3)、①“过滤”所得产品呈棕黄色,则FePO4可能混有的杂质是。②洗涤FePO4沉淀的操作是 。
(4)、FeSO4与(NH4)2SO4反应可制得摩尔盐[(NH4)2Fe (SO4)2.6H2O]。摩尔盐易溶于水.不溶于乙醇,性质比一般亚铁盐稳定,接近100℃时易失去结晶水。相关物质的溶解度曲线如图所示。
请补充完整由久置于空气中的FeSO4.7H2O样品合成摩尔盐的.实验步骤:将样品溶于适量的硫酸溶液中,加热使其溶解,然后向其中加入。可选试剂:蒸馏水、饱和硫酸铵溶液、 3% H2O2、铜粉、铁粉、无水乙醇。
13. 氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:实验Ⅰ:制取NaClO2晶体按下图装置进行制取。


已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2 , 高于60℃时NaClO2分解成NaClO3和NaCl。
(1)、用50%双氧水配制30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要(填仪器名称);(2)、装置C的作用是;(3)、装置B内生成的ClO2气体与装置D中混合溶液反应生成NaClO2 , 生成NaClO2的反应方程式为。(4)、如果撤去D中的冷水浴,可能导致产品中混有的杂质是;(5)、反应后,经以下步骤可从装置D的溶液获得NaClO2晶体。请补充完整操作③。①55℃蒸发结晶; ②趁热过滤; ③;④低于60℃干燥,得到成品。
实验Ⅱ:样品杂质分析与纯度测定
(6)、上述实验制得的NaClO2晶体中含少量Na2SO4。产生Na2SO4最可能的原因是;a.B中有SO2气体产生,并有部分进入D装置内
b.B中浓硫酸挥发进入D中与NaOH中和
c.B中的硫酸钠进入到D装置内
(7)、测定样品中NaClO2的纯度。测定时进行如下实验:准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl- , 将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是;
②所称取的样品中NaClO2的物质的量为(用含c、V的代数式表示)。
14.(1)、铝土矿(主要成分为Al2O3 , 还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
①沉淀A、B的成分分别是、;步骤②中的试剂a是;(以上均填化学式)。
②试写出步骤③中发生反应的离子方式、;
③简述检验所得滤液甲中存在Fe3+的操作方法:。
(2)、用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:
已知:在pH为4~5时,Fe3+几乎完全转化为Fe(OH)3沉淀,Cu2+却不反应。
①氧化剂最好选用(填编号)。
A.KMnO4 B.HNO3 C.Cl2
②写出“酸溶”时主要的离子方程式
③从滤液经过结晶得到氯化铜晶体的方法是(按实验先后顺序选填编号)。
A.过滤 B.蒸发至干 C.冷却结晶 D.蒸发浓缩