备考2019年高考化学二轮专题 14 综合实验探究与设计
试卷更新日期:2019-04-04 类型:二轮复习
一、单选题
-
1. 向四支试管中分别加入少量不同的无色溶液进行如下操作,现象、结论正确的是( )
操作
现象
结论
A
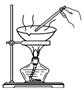
加入浓NaOH溶液,加热,将湿润红色石蕊试纸置于试管口
试纸不变蓝
原溶液中一定无NH4+
B
加入苯,振荡、静置
分层,下层溶液显橙红色
原溶液中一定有溴单质
C
滴加氯化钡溶液,再加盐酸
白色沉淀产生
一定有SO42-
D
用洁净铁丝蘸取溶液进行焰色反应
火焰呈黄色
原溶液一定含钠盐
A、A B、B C、C D、D2. 检验下列物质的试剂、现象都正确的是( )选项
被检验的物质
使用的试剂或方法
实验现象
A
Fe3+
KSCN溶液
溶液出现血红色沉淀
B
SO2
品红溶液
品红溶液褪色,加热不能复原
C
Na+
用铂丝蘸取少量溶液在火焰上灼烧
透过蓝色钴玻璃看到紫色火焰
D
NH4+
NaOH溶液、石蕊试纸
加入NaOH溶液后加热,产生的气体使湿润的红色石蕊试纸变蓝
A、A B、B C、C D、D3. 下列实验装置或操作正确的是( )A
B
C
D
从碘水中分离出碘
检验溶液中NH4+的存在

干燥SO2气体

收集HCl气体
A、A B、B C、C D、D4. 某研究小组成员设计鉴别浓硫酸和稀硫酸的如下方案,不合理的是 ( )操作
结论
A
将火柴梗伸入溶液中
变黑者为浓硫酸
B
加入金属铝片
产生刺激性气味者为稀硫酸
C
分别加入到盛水的试管中
放热者为浓硫酸
D
加到CuSO4·5H2O晶体中
变白者为浓硫酸
A、A B、B C、C D、D5. 已知:2FeSO4 Fe2O3+SO2↑+SO3↑,利用下图所示装置检验硫酸亚铁的分解产物(乙、丙、丁中的试剂是足量的)。下列说法中错误的是( ) A、乙、丙、丁中依次盛装的试剂可以是BaCl2溶液、品红溶液、NaOH溶液 B、实验开始时,先打开K1和K2 , 缓缓通入N2一段时间,再点燃酒精喷灯加热 C、若丙中盛装的是酸性KMnO4溶液检验SO2气体时,则SO2表现出还原性 D、为了检验甲中残留固体中含有Fe3+ , 取少量固体加入稀硝酸溶解,再滴加KSCN溶液6. 现有如下所示4个装置图,以下说法中正确的是( )
A、乙、丙、丁中依次盛装的试剂可以是BaCl2溶液、品红溶液、NaOH溶液 B、实验开始时,先打开K1和K2 , 缓缓通入N2一段时间,再点燃酒精喷灯加热 C、若丙中盛装的是酸性KMnO4溶液检验SO2气体时,则SO2表现出还原性 D、为了检验甲中残留固体中含有Fe3+ , 取少量固体加入稀硝酸溶解,再滴加KSCN溶液6. 现有如下所示4个装置图,以下说法中正确的是( ) A、①装置可用于比较NaHCO3和Na2CO3的稳定性 B、用酒精萃取溴水中的溴可选择②装置 C、如③装置进行实验可看到酸性KMnO4溶液褪色 D、④装置可用于实验室制取并收集少量SO2
A、①装置可用于比较NaHCO3和Na2CO3的稳定性 B、用酒精萃取溴水中的溴可选择②装置 C、如③装置进行实验可看到酸性KMnO4溶液褪色 D、④装置可用于实验室制取并收集少量SO2二、实验探究题
-
7. 用如图所示装置(夹持仪器省略)进行实验,将液体A逐渐加入固体B中。回答下列问题:
 (1)、图中D装置在实验中的作用;(2)、若A中为浓盐酸,B中为高锰酸钾,C中盛有KI淀粉溶液,旋开E后,C中的现象是溶液变蓝色,试写出A与B反应的化学方程式:(3)、若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E足够长的时间后,C中的现象是 , C中发生反应的化学方程式为:;8. 实验题
(1)、图中D装置在实验中的作用;(2)、若A中为浓盐酸,B中为高锰酸钾,C中盛有KI淀粉溶液,旋开E后,C中的现象是溶液变蓝色,试写出A与B反应的化学方程式:(3)、若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E足够长的时间后,C中的现象是 , C中发生反应的化学方程式为:;8. 实验题某研究性学习小组设计了如图装置制取和验证SO2的性质。

请回答:
(1)、写出图中仪器的名称:a , b。(2)、棉球中NaOH 溶液的作用是。(3)、为了验证SO2是酸性氧化物,洗气瓶②中可选择的试剂是 。A、紫色石蕊试液 B、无色酚酞试液 C、澄清石灰水 D、碘水(4)、下列说法正确的是 。A、实验开始时,只需打开分液漏斗的旋塞,即可使液体顺利滴下 B、先向装置中加入试剂(药品),再进行气密性检查 C、实验开始后,洗气瓶①和③只溶液均褪色,两者均可证明SO2具有漂白性 D、实验开始后,洗气瓶④中可观察到白色沉淀产生,该现象可说明SO2具有还原性9. 硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:物质
熔点/℃
沸点/℃
其它性质
SO2Cl2
-54.1
69.1
①易水解,产生大量白雾
②易分解:SO2Cl2 SO2↑+Cl2↑
H2SO4
10.4
338
吸水性且不易分解
实验室用干燥、纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:
 (1)、仪器A冷却水的进水口为(填“a”或“b”)。(2)、仪器B中盛放的药品是 , 其目的是。(3)、实验时,装置丁中发生反应的离子方程式为 , 当生成6.72L的氯气(标况下),转移电子的数目为。(4)、装置丙中盛放的试剂是 , 若缺少装置乙,对实验造成的影响是。(5)、少量硫酰氯也可用液态氯磺酸(ClSO3H)低温催化分解获得,该反应的化学方程式为:2ClSO3H=H2SO4 + SO2Cl2 , 从分解产物中分离出硫酰氯的操作是。10. 某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行相关实验。
(1)、仪器A冷却水的进水口为(填“a”或“b”)。(2)、仪器B中盛放的药品是 , 其目的是。(3)、实验时,装置丁中发生反应的离子方程式为 , 当生成6.72L的氯气(标况下),转移电子的数目为。(4)、装置丙中盛放的试剂是 , 若缺少装置乙,对实验造成的影响是。(5)、少量硫酰氯也可用液态氯磺酸(ClSO3H)低温催化分解获得,该反应的化学方程式为:2ClSO3H=H2SO4 + SO2Cl2 , 从分解产物中分离出硫酰氯的操作是。10. 某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行相关实验。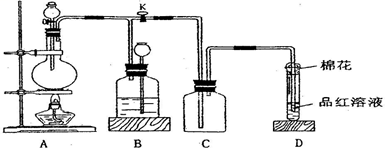
请回答:
(1)、装置 A 中发生的化学反应方程式为。(2)、装置 D 中试管口放置的棉花中应浸一种液体,这种液体最好是下列哪种 , 其作用是。a.NaOH 溶液
b.NaCl 溶液
c.H2O
d.NH4Cl 溶液
(3)、装置 B 的作用是贮存多余的气体。当 D 处有明显的现象后,关闭旋塞 K 并移去酒精灯,但由于余热的作用,A 处仍有气体产生,此时 B 中现象是。B 中应放置的液体是(填字母)。a.水
b.酸性 KMnO4 溶液
c.饱和 NaHSO3 溶液
d.浓溴水
(4)、实验中,取一定质量的铜片和一定体积 18 mol·L—1 的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。①有一定量的余酸但未能使铜片完全溶解,你认为原因是。
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的物质是(填字母)。
a.BaCl2 溶液
b.锌粉
c.紫色石蕊试液
d.滴有酚酞的 NaOH 溶液
11. 某化学兴趣小组用如图所示装置制取氯酸钾、次氯酸钠和氯水并进行有关探究实验。
实验Ⅰ.制取氯酸钾、次氯酸钠和氯水
(1)、写出装置A实验室制取Cl2的化学方程式。(2)、制取实验结束后,取出装置B中试管,冷却结晶、过滤、洗涤。该实验操作过程需要的玻璃仪器有胶头滴管、烧杯、、。为提高氯酸钾和次氯酸钠的产率,在实验 装置中还需要改进的是。(3)、装置C中反应需要在冰水浴中进行,其原因是。(4)、装置D中的实验现象是溶液先变红后褪色,最后又变为色。(5)、实验Ⅱ.尾气处理实验小组利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响)。
①提出合理假设
假设1:只存在SO32-;假设2:即不存在SO32- , 也不存在ClO-;假设3:。
②设计实验方案,进行实验。请完成下列表格,写出相应的实验步骤以及预期现象和结论。限选实验试剂:3 mol·L-1H2SO4、1 mol·L-1NaOH溶液、0.01 mol·L-1酸性KMnO4溶液、淀粉KI溶液。
实验步骤
预期现象和结论
步骤1:取少量吸收液分置于A、B试管中
步骤2:向A试管中滴加0.01 mol·L-1酸性KMnO4溶液
a.若溶液褪色,则假设1成立
b.若溶液不褪色,则假设2或3成立
步骤3:
12. Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8℃,42℃以上分解为Cl2和O2 , 可作为高效安全灭菌消毒剂。如图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1:3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。 (1)、实验中控制氯气与空气体积比的方法是。(2)、装置B中多孔球泡和搅拌棒的作用是。(3)、装置B中产生Cl2O的化学方程式为。(4)、若B无冷却装置,则进入C中的Cl2O会大量减少,其原因是。(5)、为避免Cl2影响C中溶液的溶质可以在B、C之间加一个盛有(填试剂名称)的洗气瓶。(6)、已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中次氯酸溶液的物质的量浓度的实验方案为:用(填仪器名称)取20.00mL次氯酸溶液放入烧杯中,向其中(填操作),过滤,洗涤沉淀,在真空干燥箱中干燥,用电子天平称量沉淀质量。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液)13. 水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl据此,某学生设计了下列实验。
(1)、实验中控制氯气与空气体积比的方法是。(2)、装置B中多孔球泡和搅拌棒的作用是。(3)、装置B中产生Cl2O的化学方程式为。(4)、若B无冷却装置,则进入C中的Cl2O会大量减少,其原因是。(5)、为避免Cl2影响C中溶液的溶质可以在B、C之间加一个盛有(填试剂名称)的洗气瓶。(6)、已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中次氯酸溶液的物质的量浓度的实验方案为:用(填仪器名称)取20.00mL次氯酸溶液放入烧杯中,向其中(填操作),过滤,洗涤沉淀,在真空干燥箱中干燥,用电子天平称量沉淀质量。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液)13. 水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl据此,某学生设计了下列实验。【制备NaClO溶液】实验装置如下图图甲所示(部分夹持装置已省略)
已知:3NaClO 2NaCl+NaClO3
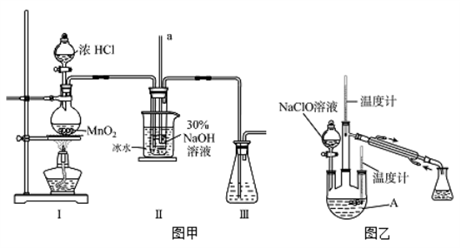 (1)、配制30 %NaOH溶液时,所需玻璃仪器除量筒外还有__________(填字母)。A、容量瓶 B、烧杯 C、移液管 D、玻璃棒(2)、装置I中发生的离子反应方程式是;Ⅱ中玻璃管a的作用为;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的(3)、【制取水合肼】
(1)、配制30 %NaOH溶液时,所需玻璃仪器除量筒外还有__________(填字母)。A、容量瓶 B、烧杯 C、移液管 D、玻璃棒(2)、装置I中发生的离子反应方程式是;Ⅱ中玻璃管a的作用为;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的(3)、【制取水合肼】实验装置如上图图乙所示,反应过程中,如果分液漏斗中溶液的滴速过快, 部分N2H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
(4)、【测定肼的含量】称取馏分0.3000 g,加水配成20.0 mL溶液,一定条件下用0.1500 mol·L-1的I2溶液滴定。已知: N2H4·H2O + 2I2 = N2↑+ 4HI + H2O。
①滴定时,可以选用的指示剂为;
②实验测得消耗I2溶液的平均值为20. 00 mL,馏分中N2H4·H2O的质量分数为。
14. 实验室常用乙醇与浓硫酸来制取乙烯,反应装置如下图A所示,发生反应为CH3CH2OH CH2=CH2↑+H2O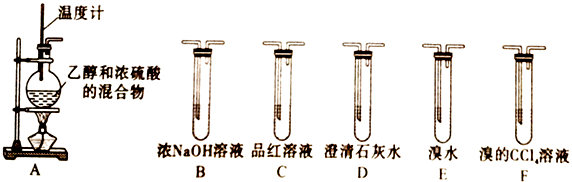
请回答下列问题:
(1)、Ⅰ.制取实验中,混合乙醇与浓硫酸的操作是 , 通常在圆底烧瓶中加入几粒碎瓷片的作用是 , 装置A图中一处明显的错误是。(2)、Ⅱ.用该方法在实验室制取乙烯时,常会看到烧瓶中液体变黑,并使装置A中制得的乙烯中混有CO2、SO2等杂质气体。为确定乙烯及各种杂质气体的存在,请用上面给出的实验装置完成下面的实验探究设计。探究设计1:若要检验A中所得气体含有SO2 , 可将混合气体直接通入(填装置代号,下同)装置;若要检验A中所得气体含有乙烯,可将混合气体直接通入。
(3)、探究设计2:若将A中所得气体依次通过①→②→③→E装置,根据实验现象可确定乙烯气体中混有二氧化硫气体。则:①设计2中①→②→③装置对应的装置分别是(填装置代号)。
②设计2中能说明二氧化硫气体存在的现象是。
③使用装置②的目的是。使用装置③的目的是。
④设计2中确认乙烯气体存在的现象是。
探究设计3:若要一次性将乙烯、CO2、SO2三种气体全部检验出来,气体被检验出来的先后顺序是 , 气体通过装置的顺序为A→(填装置代号)。
三、综合题
-
15. 明矾[ KAl(SO4)2·12H2O ]在造纸、净水等方面应用广泛。以处理过的废旧易拉罐碎屑为原料(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。

回答下列问题:
(1)、原料溶解过程中反应的离子方程式是。(2)、Al(OH)3 与稀硫酸反应的离子方程式是。(3)、溶液A中通入过量CO2 , 反应的离子方程式是。(4)、为证明固体B中含有铁,某同学做如下实验:取少量固体B,加入稀硫酸使其溶解,观察到有无色气体生成。向溶液中加入 , 溶液立即变红,证明固体B中含有铁。16. CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并验证其它分解产物。(查阅资料)
①

②CuCl是一种白色难溶固体,潮湿CuCl在空气中缓慢被氧化
(1)、配平潮湿CuCl在空气中被氧化的化学方程式:CuCl+O2+ =3CuO·CuCl2·3H2O+HCl
(2)、(实验探究)该小组选用下图装置进行实验(夹持加热仪器略)。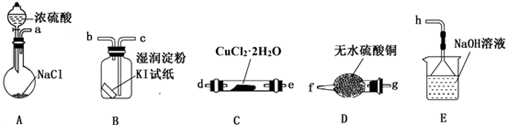
装置A用于制取HCl:NaCl+H2SO4=NaHSO4+HCl↑,浓硫酸在该反应中体现强酸性和性;
(3)、按实验要求选择上图装置,连接顺序为:a(按气流方向,用小写字母表示);(4)、根据完整的实验装置进行实验,实验步骤如下:①连接装置,;②装入药品;③打开分液漏斗活塞;④控制温度加热硬质玻璃管一段时间;⑤停止通HCl,升温继续加热;步骤④通HCl的目的是;
(5)、装置E中发生反应的离子方程式是。(6)、(实验分析与改进)装置B中试纸先变蓝后又褪色,经查资料获知过量的Cl2能将I2氧化。甲同学认为可将湿润的淀粉KI试纸改成足量的淀粉KI溶液以克服Cl2过量的问题,但小组分析后认为该方案存在一个明显安全问题:
(7)、反应结束后,CuCl产品中可能含有少量未分解的CuCl2 , 乙同学认为只用一种日常生活常见的液体即可检验。该实验方案为:取少量固体放入小试管中,。