备考2019年高考化学二轮专题 13 基本实验操作和分析
试卷更新日期:2019-04-04 类型:二轮复习
一、单选题
-
1. 下列仪器属于碱式滴定管的是( )A、
 B、
B、 C、
C、 D、
D、
-
2. 用制溴苯的废催化剂(主要含FeBr3及少量溴、苯)为原料,制取无水FeCl3和溴的苯溶液,选用的方法能达到相应实验目的的是()
装置①
 装置②
装置②  装置③
装置③ 
装置④
 装置⑤
装置⑤  A、用装置①及其试剂制取氯气 B、用装置②氧化FeBr3溶液中的溴离子 C、用装置③分离出FeCl3溶液,不能选用装置④分离 D、用装置⑤将FeCl3溶液蒸发至干,可得无水FeCl3
A、用装置①及其试剂制取氯气 B、用装置②氧化FeBr3溶液中的溴离子 C、用装置③分离出FeCl3溶液,不能选用装置④分离 D、用装置⑤将FeCl3溶液蒸发至干,可得无水FeCl3 -
3. 下列有关实验的选项正确的是( )




A.配制0.10 mol·L-1NaOH溶液
B.苯萃取碘水中I2 , 分出水层后的操作
C.除去CO中的CO2
D.记录滴定终点读数为12.20mL
A、A B、B C、C D、D -
4. 物质的性质不同,其存放的方法也不同。下列物质的存放方法正确的是( )A、浓硫酸可敞口保存在细口瓶中 B、液溴存放在加有少量水的棕色试剂瓶中 C、氢氟酸密封保存在细口玻璃瓶中 D、金属钠密封保存在装有水的试剂瓶中
-
5. 根据所给信息和标志,判断下列说法错误的是( )
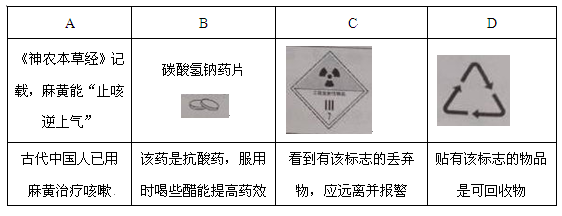 A、A B、B C、C D、D
A、A B、B C、C D、D -
6. 在实验室中,对下列事故或药品的处理正确的是( )A、有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场 B、金属钠着火燃烧时,用泡沫灭火器灭火 C、少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 D、含硫酸的废液倒入水槽,用水冲入下水道
-
7. 下列试剂贮存方法错误的是( )A、钠应保存在石蜡油或煤油中 B、氢氟酸保存在玻璃瓶中 C、新制氯水保存在棕色试剂瓶中 D、烧碱溶液可用带橡皮塞的玻璃瓶暂时保存
-
8. 为了除去粗盐中的CaCl2、MgCl2、Na2SO4及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。正确的操作顺序是 ( )A、①④②⑤③ B、④①②⑤③ C、⑤④①②③ D、⑤②④①③
-
9. 在不用指示剂的情况下,欲将氯化钙溶液中的盐酸除去,最好选用下列物质中的( )A、碳酸钙粉末 B、生石灰粉末 C、石灰水 D、熟石灰粉末
-
10. 某溶液中可能含有 、 、 、 、 分别取样: 测得溶液显弱酸性; 滴加氯水和淀粉至过量,始终无明显现象。为确定该溶液的组成,必须的检验方法或试剂是()A、焰色反应 B、NaOH溶液(加热) C、
 酸化
酸化  溶液
D、
溶液
D、 气体
气体
-
11. 下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)()
选项
待提纯的物质
选用的试剂
操作方法
A
NaCl(Na2CO3)
硝酸
蒸发
B
酒精(水)
生石灰
萃取分液
C
Zn (Cu)
稀硫酸
过滤
D
CO2(HCl)
饱和碳酸氢钠溶液
洗气
A、A B、B C、C D、D -
12. 下列实验装置或操作正确的是( )
A
B
C
D
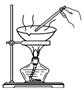
从碘水中分离出碘
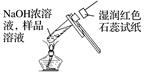
检验溶液中NH4+的存在

干燥SO2气体

收集HCl气体
A、A B、B C、C D、D -
13. 实验是探究化学过程的重要途径,有关下列各实验装置图的叙述正确的是( )
 A、图 I 可用于探究 NaHCO3 固体的热稳定性 B、图Ⅱ用于从氯化钠溶液中获得晶体 C、图 III 中 b 口进气可收集 Cl2、CO2 等气体 D、图Ⅳ中若 X 为 NaOH 溶液,则可完成 SO2 的喷泉实验
A、图 I 可用于探究 NaHCO3 固体的热稳定性 B、图Ⅱ用于从氯化钠溶液中获得晶体 C、图 III 中 b 口进气可收集 Cl2、CO2 等气体 D、图Ⅳ中若 X 为 NaOH 溶液,则可完成 SO2 的喷泉实验 -
14. 实验是化学研究的基础。下列关于各实验装置的叙述正确的是( )
 A、装置①常用于分离互不相溶的液体混合物 B、装置②可用于吸收NH3或HCl气体,并防止倒吸 C、装置③可用于收集H2、CO2、Cl2、NH3等气体 D、装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
A、装置①常用于分离互不相溶的液体混合物 B、装置②可用于吸收NH3或HCl气体,并防止倒吸 C、装置③可用于收集H2、CO2、Cl2、NH3等气体 D、装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢 -
15. 完成下列实验,所选装置正确的是( )
A
B
C
D
实验目的
检查装置气密性
实验室用纯碱和稀硫酸制备二氧化碳
用已知浓度的氢氧化钠溶液测定未知浓度盐酸
选择合适的试剂,可分别制取少量CO2、NO和O2
实验
装置



 A、A B、B C、C D、D
A、A B、B C、C D、D -
16. 下列实验装置或操不能达到实验目的的是( )
 A、图1可用于实验室制取硝基苯 B、图2可用于测定CO2的生成速率 C、图3可用于除去甲烷中少量的乙烯得纯净甲烷 D、图4可用于石油的蒸馏
A、图1可用于实验室制取硝基苯 B、图2可用于测定CO2的生成速率 C、图3可用于除去甲烷中少量的乙烯得纯净甲烷 D、图4可用于石油的蒸馏
二、实验探究题
-
17. 某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
 (1)、称取13.0 g草酸晶体,配成250.00 mL水溶液.此操作过程必须用到的2种定量仪器是 和 .(2)、量取草酸溶液25.00 mL放入锥形瓶中,用0.2000 mol/L的酸性KMnO4溶液滴定.
(1)、称取13.0 g草酸晶体,配成250.00 mL水溶液.此操作过程必须用到的2种定量仪器是 和 .(2)、量取草酸溶液25.00 mL放入锥形瓶中,用0.2000 mol/L的酸性KMnO4溶液滴定.①量取25.00 mL草酸溶液
②酸化KMnO4溶液的酸应为 .(选填“盐酸”或“稀硫酸”或“稀硝酸”)
③配平离子方程式:□MnO4-+□H2C2O4+□H+→□Mn2++□CO2↑+□H2O
④滴定达到终点的标志是 .
(3)、在上述实验中,下列操作一定会造成测定结果偏低的是 ______ .A、称取13.0 g草酸晶体时,将草酸晶体放在托盘天平右盘 B、锥形瓶水洗后未用草酸溶液润洗 C、读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数 D、盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失. -
18. 室温下,某同学进行CO2与Na2O2反应的探究实验,回答下列问题。
(1)、用下图装置制备纯净的CO2
①丙装置的名称是 , 乙、丙装置中盛装的试剂分别是、。
②若CO2中混有HCl,则HCl与Na2O2反应的化学方程式为。
(2)、按照下面的装置图进行实验(夹持装置略)。
①先组装仪器,然后 , 再用注射器1抽取100mL纯净的CO2 , 将其连接在K1处,注射器2的活塞推到底后连接在K2处,具支U形管中装入足量的Na2O2粉末与玻璃珠。
②打开止水夹K1、K2,向右推动注射器1的活塞,可观察到的现象是。
③实验过程中,需缓慢推入CO2 , 其目的是 , 为达到相同目的,还可进行的操作是。
(3)、实验结束后,当注射器1的活塞推到底时,测得注射器2中气体体积为65mL,则CO2的转化率是。 -
19. 某学生设计氨催化氧化实验,并将制得NO进一步氧化为NO2用水吸收NO2 , 并检验HNO3的生成。
可供选择的固体药品有:NH4Cl、Ca(OH)2、KClO3、MnO2、CaO
可供选择的液体药品有:浓氨水、过氧化氢、浓盐酸、水
可供选择的仪器有:如图

另有铁架台、铁夹、铁圈、乳胶管若干,可供选择。设计实验时,A和B两个制气装置允许使用两次,其余装置只能使用一次。
(1)、氨氧化制NO的化学反应为 , 该反应应在装置中进行。(2)、为快速制NH3和O2 , 制取NH3的装置最好选择 , 其化学反应方程式为;制取O2的装置最好选择。(3)、装置C的作用是。(4)、装置H中溶液变红,其原因是(用化学方程式表示)。 -
20. 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,在印染、医药以及原子能工业中有广 泛应用。以 Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下: 已知:次硫酸氢钠甲醛易溶于水,微溶于乙醇,具有强还原性,且在 120℃以上发生分解。
步骤 1:在三颈烧瓶中加入一定量 Na2SO3 和水,搅拌溶解,缓慢通入 SO2 , 至溶液 pH 约为 4,制得 NaHSO3溶液。
步骤 2:将装置 A 中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在 80~90℃下, 反应约 3h,冷却至室温,抽滤;

步骤 3:将滤液真空蒸发浓缩,冷却结晶。
(1)、装置 B的烧杯中应加入的溶液是;冷凝管中冷却水从填“a”或“b”)口进水。(2)、A 中多孔球泡的作用是。(3)、冷凝管中回流的主要物质除 H2O 外还有(填化学式)。(4)、写出步骤 2 中发生反应的化学方程式。(5)、步骤 3 中在真空容器中蒸发浓缩的原因是。(6)、为了测定产品的纯度,准确称取 2.0g 样品,完全溶于水配成 100mL 溶液,取 20.00mL 所配溶液, 加入过量碘完全反应后(已知 I2 不能氧化甲醛,杂质不反应),加入 BaCl2 溶液至沉淀完全,过滤、洗涤、 干燥至恒重得到白色固体 0.466g,则所制得的产品的纯度为 。
三、综合题
-
21. 掌握仪器的名称、组装及使用方法是中学化学实验的基础,如下图为两套实验装置。
 (1)、写出下列仪器的名称:① ④ 。(2)、若利用装置Ⅰ分离四氯化碳和酒精的混合物,还缺少的仪器是 , 冷凝管的进水口是 (填“f”或“g”)。(3)、某校环保兴趣小组在处理污水样品时,需用质量分数为36.5% 、密度为1.2g/cm3 的浓盐酸配制成250mL 0.1mol/L的稀盐酸溶液。装置Ⅱ是某同学转移溶液的示意图,图Ⅱ中的两处错误分别是。(4)、根据计算,本实验需要量取浓盐酸的体积为 mL,本实验应使用的量筒是。
(1)、写出下列仪器的名称:① ④ 。(2)、若利用装置Ⅰ分离四氯化碳和酒精的混合物,还缺少的仪器是 , 冷凝管的进水口是 (填“f”或“g”)。(3)、某校环保兴趣小组在处理污水样品时,需用质量分数为36.5% 、密度为1.2g/cm3 的浓盐酸配制成250mL 0.1mol/L的稀盐酸溶液。装置Ⅱ是某同学转移溶液的示意图,图Ⅱ中的两处错误分别是。(4)、根据计算,本实验需要量取浓盐酸的体积为 mL,本实验应使用的量筒是。(在横线上填写相应的字母,否则无分,下同)
A. 10mL B. 50mL C. 100mL D. 250mL
(5)、在容量瓶的使用方法中,下列操作正确的是 。A、使用容量瓶前检查它是否漏水 B、容量瓶用水洗净后,再用配好的稀HCl溶液润洗 C、配制溶液时,如果试样是固体,把称好的试样用纸槽小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线 D、配制溶液时,若试样是液体,用量筒取试样后直接倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线 E、盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
