浙教版科学九年级上学期科学期中测试试卷
试卷更新日期:2019-03-29 类型:期中考试
一、选择题
-
1. 下列实验操作中,不正确的是( )
A、稀释浓硫酸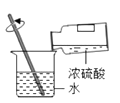 B、测溶液 pH
B、测溶液 pH  C、闻食醋
C、闻食醋  D、检查装置气密性
D、检查装置气密性 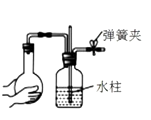 2. 归纳和演绎是重要的科学方法。下列归纳或演绎合理的是( )A、有机物是一类含碳化合物,所以 CH4、CO2 都是有机物 B、硫酸、盐酸电离时都能产生H+ , 所以电离能产生 H+的化合物是酸 C、金属Fe、Zn能与酸反应生成氢气,所以金属都能与酸反应生成氢气 D、氧化物由两种元素组成,其中一种是氧元素的化合物,所以水是氧化物3. “一带一路”是跨越时空的宏伟构想,赋予古丝绸之路崭新的时代内涵,古丝绸之路将中 国的发明和技术传送到国外,下列不属于化学变化的是( )A、稻草造纸 B、使用火药 C、冶炼金属 D、蚕丝织绫4. 如表是生活中常见4种饮料及主要成分,下列关于这些饮料的组成、性质和用途表述错误的是( )
2. 归纳和演绎是重要的科学方法。下列归纳或演绎合理的是( )A、有机物是一类含碳化合物,所以 CH4、CO2 都是有机物 B、硫酸、盐酸电离时都能产生H+ , 所以电离能产生 H+的化合物是酸 C、金属Fe、Zn能与酸反应生成氢气,所以金属都能与酸反应生成氢气 D、氧化物由两种元素组成,其中一种是氧元素的化合物,所以水是氧化物3. “一带一路”是跨越时空的宏伟构想,赋予古丝绸之路崭新的时代内涵,古丝绸之路将中 国的发明和技术传送到国外,下列不属于化学变化的是( )A、稻草造纸 B、使用火药 C、冶炼金属 D、蚕丝织绫4. 如表是生活中常见4种饮料及主要成分,下列关于这些饮料的组成、性质和用途表述错误的是( )名称
主要成分
雪碧
碳水化合物、水
苏打水(弱碱性)
碳酸氢钠、水
盐汽水
氯化钠、水
柠檬汁
水、碳水化合物、蛋白质、纤维、维生素等
A、雪碧是一种混合物 B、4种饮料中,苏打水的pH值最小 C、从事高温作业的人员,适宜补充盐汽水 D、喝适量柠檬汁有助于补充人体的维生素5. 如图为某文化衫图案,你的美(Mg)偷走我的心(Zn)能发生,是由于镁的( ) A、延展性好 B、导电性好 C、导热性好 D、金属活动性比锌强6. 下列实验中,根据现象得出的结论,正确的是( )
A、延展性好 B、导电性好 C、导热性好 D、金属活动性比锌强6. 下列实验中,根据现象得出的结论,正确的是( )选项
实验
现象
结论
A
CO2通入紫色石蕊试液
石蕊试液变红
CO2具有酸的性质
B
黄豆和芝麻混合后振荡
总体积变小
分子之间有空隙
C
稀H2SO4溶液中滴入NaOH溶液
无明显现象
H2SO4和NaOH没有发生化学反应
D
冷却CuSO4热饱和溶液
有晶体析出
CuSO4的溶解度随温度降低而减小
A、A B、B C、C D、D7. 铁、铝、铜是生活中常用的金属。下列有关说法或者做法,正确的是( )A、铁制品表面生锈后不必立即清除,因为铁锈能阻止内部的铁继续生锈 B、铝制品有较强的耐腐蚀性,因为铝表面有一层致密的氧化物保护膜,故可以用铝容器来盛醋 C、铜的化学性质不活泼,所以可以把铜放在潮湿环境中,不必担心它会生锈 D、“暖宝宝”中有铁粉,氯化钠和水等,其发热原理是铁氧化放热,“暖宝宝”应密封保存8. 下列有关化学反应类型的判断,不正确的是( )A、CO2+C 2CO 化合反应
B、CaCO3
2CO 化合反应
B、CaCO3  CaO+CO2↑ 分解反应
C、CO+CuO
CaO+CO2↑ 分解反应
C、CO+CuO  Cu+CO2 置换反应
D、Ba(OH)2+2HCl=BaCl2+2H2O 复分解反应
9. 下列物质能大量共存于水溶液中的是( )A、硝酸、氢氧化钙、氯化钠 B、硝酸钾、氯化铜、硫酸钠 C、氢氧化钠、硫酸镁、氯化钡 D、盐酸、碳酸钠、硝酸钙10. 下列转化不能通过一步反应实现的是( )A、Fe2O3→Fe B、CO2→CO C、NaNO3→NaCl D、CO2→CaCO311. 设计对比实验,控制变量是学习化学的重要方法,下列对比实验不能达到目的的是( )
Cu+CO2 置换反应
D、Ba(OH)2+2HCl=BaCl2+2H2O 复分解反应
9. 下列物质能大量共存于水溶液中的是( )A、硝酸、氢氧化钙、氯化钠 B、硝酸钾、氯化铜、硫酸钠 C、氢氧化钠、硫酸镁、氯化钡 D、盐酸、碳酸钠、硝酸钙10. 下列转化不能通过一步反应实现的是( )A、Fe2O3→Fe B、CO2→CO C、NaNO3→NaCl D、CO2→CaCO311. 设计对比实验,控制变量是学习化学的重要方法,下列对比实验不能达到目的的是( )选项
A
B
C
D
实验设计




实验目的
探究同种物质在不同溶剂中的溶解性
探究物质燃烧的条件
探究铁生锈的条件
探究CO2与NaOH溶液能否发生反应
A、A B、B C、C D、D12. 小明同学将一枚洁净的铁钉放入硫酸铜溶液中,观察到铁钉表面有红色的物质析出,且产生少量的气体。于是,他们重新配制硫酸铜溶液,再次实验,又观察到相同的现象,关于该实验,有如下说法:①生成的气体可能是氢气 ②完全反应后溶液呈黄色
③实验中一定发生了置换反应 ④由实验可以得出金属活动性顺序:Cu>Fe
⑤硫酸铜溶液可能显酸性 ⑥重做实验没有任何意义
其中正确的说法是( )
A、①②③ B、①③⑤ C、④⑤⑥ D、③⑤⑥13. 小金提着装有30个鸡蛋的塑料袋从1楼走到5楼的家里。下列对此过程中做功和功率的估算,合理的是( )A、他提鸡蛋的力做的功约为200焦 B、他提鸡蛋的力做功的功率约为3 000瓦 C、他爬楼做的功约为6×103焦 D、他爬楼做功的功率约为1×104瓦14. 如图所示,甲、乙和丙是三个完全相同的乒乓球,在离地同一高度处以大小相等的速度v,将三个球分别竖直向下、竖直向上和水平抛出。若在整个运动过程中不计能量损失,则( ) A、抛出时甲球的机械能大于其他两个球 B、抛出后乙球的机械能先增大再减小 C、第一次落地时甲球的动能最大,丙球的动能最小 D、落地后第一次反弹到最高点时甲、乙两球的高度相同15. 小明用两个相同的滑轮组成不同的滑轮组(如图所示),分别将同一物体以相同速度提高到相同高度,滑轮组的机械效率分别为η1、η2 , 拉力分别为F1、F2 , 拉力的功率分别为P1、P2 , 忽略绳重及摩擦,下列关系正确的是( )
A、抛出时甲球的机械能大于其他两个球 B、抛出后乙球的机械能先增大再减小 C、第一次落地时甲球的动能最大,丙球的动能最小 D、落地后第一次反弹到最高点时甲、乙两球的高度相同15. 小明用两个相同的滑轮组成不同的滑轮组(如图所示),分别将同一物体以相同速度提高到相同高度,滑轮组的机械效率分别为η1、η2 , 拉力分别为F1、F2 , 拉力的功率分别为P1、P2 , 忽略绳重及摩擦,下列关系正确的是( ) A、F1>F2 η1=η2 P1=P2 B、F1<F2 η1=η2 P1<P2 C、F1>F2 η1=η2 P1>P2 D、F1>F2 η1>η2 P1=P2
A、F1>F2 η1=η2 P1=P2 B、F1<F2 η1=η2 P1<P2 C、F1>F2 η1=η2 P1>P2 D、F1>F2 η1>η2 P1=P2二、填空与简答题
-
16. 金属是一类重要的材料,在日常生活和工农业生产中有广泛的应用。(1)、高层建筑的楼顶常装有用钢铁做的避雷针,其作用是将雷电引导到地下,这说明钢铁具有良好的性(填一物理性质);(2)、小王家厨房里的菜刀生锈了,铁生锈需要有(填名称)的参与。除锈可以用砂纸打磨,也可以通过化学方法用厨房中的除锈。17. 小科以化合价为纵坐标、以物质类别为横坐标绘制了下图,每种物质中都有一种元素的化合价与纵坐标的数值对应,图中字母均表示初中科学中的常见物质,其中“→”表示物质间的转化关系。已知A中氧元素的质量分数为60%,C、D、E、F均含有铜元素。请回答:
 (1)、“A+H2O=B”的反应属于基本反应类型中的;(2)、写出B和D反应得到C和水的化学方程式;(3)、列举3种能与E反应得到F的物质。18. 在“探究杠杆的平衡条件”实验中:
(1)、“A+H2O=B”的反应属于基本反应类型中的;(2)、写出B和D反应得到C和水的化学方程式;(3)、列举3种能与E反应得到F的物质。18. 在“探究杠杆的平衡条件”实验中: (1)、图甲中,为使杠杆在水平位置平衡,应将右端的平衡螺母向侧调节。(2)、图乙中,杠杆恰好处于水平平衡状态,若在A处下方再挂一个钩码,则B处所挂钩码须向右移动格,可使杠杆在水平位置再次平衡。(3)、杠杆处于图甲所示位置时,小李同学就在杠杆上挂钩码进行实验,小明认为这样操作会对实验产生以下影响:
(1)、图甲中,为使杠杆在水平位置平衡,应将右端的平衡螺母向侧调节。(2)、图乙中,杠杆恰好处于水平平衡状态,若在A处下方再挂一个钩码,则B处所挂钩码须向右移动格,可使杠杆在水平位置再次平衡。(3)、杠杆处于图甲所示位置时,小李同学就在杠杆上挂钩码进行实验,小明认为这样操作会对实验产生以下影响:①杠杆自身重力可能会对实验产生影响
②可能不便于测量力臂或出现力臂测量错误
③无法得出杠杆平衡条件
你认为正确的是____。
A、①② B、①③ C、②③19. 大多数农作物一般适宜在中性或接近中性的土壤里生长,为测定某农田土壤的酸碱度,同学们取来适量土样,请完成其pH的测定:(1)、把适量土样放入烧杯,并。(2)、用玻璃棒蘸取少许土壤浸出液滴在上,显色后将其与标准比色卡对照,即可测得土壤的酸碱度。20. 如今,青少年近视的人越来越多,我们青少年看书、写字一定要爱护眼睛,台灯是在光线不足时常用的照明用具。请根据下图回答下列问题: (1)、图中标示的物质属于金属材料的有(填序号)。(2)、灯管后面的反光片为铝箔,铝块能制成铝箔是利用了铝的性。21. 将浓盐酸、氢氧化钠、石灰水三种物质的溶液长期存放在空气中,溶液质量因发生化学变化而减小的物质是 , 反应的化学方程式为 , 因发生化学变化溶液质量增大的物质是。22. 今年5月,吴王夫差剑重返苏州。吴王夫差剑为春秋末期制造的青铜剑,时隔2 500年,虽表面有一层蓝色薄锈,但仍寒光逼人,刃锋极锋利,堪称削铁如泥,吹毛断发。
(1)、图中标示的物质属于金属材料的有(填序号)。(2)、灯管后面的反光片为铝箔,铝块能制成铝箔是利用了铝的性。21. 将浓盐酸、氢氧化钠、石灰水三种物质的溶液长期存放在空气中,溶液质量因发生化学变化而减小的物质是 , 反应的化学方程式为 , 因发生化学变化溶液质量增大的物质是。22. 今年5月,吴王夫差剑重返苏州。吴王夫差剑为春秋末期制造的青铜剑,时隔2 500年,虽表面有一层蓝色薄锈,但仍寒光逼人,刃锋极锋利,堪称削铁如泥,吹毛断发。仔细阅读上面文字,完成下面问题:
(1)、青铜是金属材料中的 , 其主要成分是(填化学式)。(2)、从文中信息可以看出,青铜具有____的特点。A、强度高 B、可塑性好 C、耐腐蚀 D、易加工(3)、吴王夫差剑表面的蓝色薄锈,其主要成分为碱式碳酸铜[化学式:Cu2(OH)2CO3],这层蓝色薄锈形成的可能原因是。23. 小丽利用底部有一小孔的大试管,如图甲所示装配成一个制取CO2气体的装置。 (1)、实验前,关闭止水夹,先将试管底部稍浸没在水中,再用双手紧握试管,观察到 , 则说明装置气密性良好。(2)、小丽将CO2通入盛有NaOH溶液的试管中,观察不到明显现象。那么CO2与NaOH是否发生反应?为此又做了实验:在集满CO2的软塑料瓶(如图乙)中加入适量的NaOH溶液,盖紧瓶塞振荡,发现瓶变瘪,于是认为CO2与NaOH发生了反应,小衢提出质疑,认为导致软塑料瓶变瘪的原因还有可能是。(3)、小科从变瘪的软塑料瓶中取出少量试液置于试管中,滴入(填一种盐)溶液,观察到有白色沉淀产生,就证明了CO2与NaOH的反应确实已经发生。
(1)、实验前,关闭止水夹,先将试管底部稍浸没在水中,再用双手紧握试管,观察到 , 则说明装置气密性良好。(2)、小丽将CO2通入盛有NaOH溶液的试管中,观察不到明显现象。那么CO2与NaOH是否发生反应?为此又做了实验:在集满CO2的软塑料瓶(如图乙)中加入适量的NaOH溶液,盖紧瓶塞振荡,发现瓶变瘪,于是认为CO2与NaOH发生了反应,小衢提出质疑,认为导致软塑料瓶变瘪的原因还有可能是。(3)、小科从变瘪的软塑料瓶中取出少量试液置于试管中,滴入(填一种盐)溶液,观察到有白色沉淀产生,就证明了CO2与NaOH的反应确实已经发生。三、实验探究题
-
24. 某研究小组利用如图装置探究温度对CO还原Fe2O3的影响(固定装置略)

信息1:难溶的碳酸盐受热易分解为氧化物和CO2;
信息2:CO2能与Zn反应生成CO气体;
信息3:酒精灯的加热温度为400~500 ℃,酒精喷灯的火焰温度可达1 000 ℃左右。
(1)、D装置的加热必须在A和B装置加热一段时间后再进行,这样做的原因是。(2)、装置C的作用是 , 从实验安全或环保角度考虑,上述实验装置可采取的改进措施是。(3)、将研究小组分为两组,按上图所示装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物)。两组分别用产物进行如下表所示实验:步骤
操作
甲组现象
乙组现象
1
取黑色粉末加入盐酸
溶解,无气泡
溶解,有气泡
2
取步骤1中溶液,滴加KSCN溶液
变红
无现象
则乙组装置D中反应的化学方程式。
25. 小明买了一种“气泡爽”的冲调饮料。(1)、小明阅读资料发现:“气泡爽”原料中的柠檬酸和小苏打(NaHCO3)粉末混合后加水,可以发生以下反应,请填写柠檬酸的化学式。3NaHCO3+=C6H5O7Na3+3H2O+3CO2↑
(2)、小明想探究加水温度对产生气体量的影响,小明设计了如下实验方案。在老师的帮助下,小明采用相同的两套实验装置(如图)分别完成上述实验,在A中加入水,再加入一袋“气泡爽”,迅速塞紧胶塞。量筒C用于收集A中产生的气体所排出的液体,冷却至室温后读取数据。B中油层的作用是。

实验序号
加入水的体积
加入水的温度
收集到的气体的体积
1
200毫升
15 ℃
a(待记录)
2
200毫升
50 ℃
b(待记录)
(3)、通过实验,小明测得:a=64毫升,b=132毫升,由此获得结论:“气泡爽”产生气体的量与加水温度有关系。但是老师看到小明的实验报告后却指出:两套装置中,“气泡爽”产生气体的总量应该近似相等,与温度关系不大,其本质原因是。(4)、通过反思,为了证明老师的观点,小明继续利用(3)中已反应完的两套装置,又做了一步实验,发现两套装置最终收集到的气体的总量确实相近,他的实验操作是。26. 中和反应在工农业生产和生活中有广泛的应用。某学生课外兴趣小组对中和反应进行研究。 (1)、对于没有明显实验现象产生的中和反应,如稀盐酸与稀氢氧化钠溶液的反应,要证明它们之间确实发生了化学反应,可通过如下实验来进行。
(1)、对于没有明显实验现象产生的中和反应,如稀盐酸与稀氢氧化钠溶液的反应,要证明它们之间确实发生了化学反应,可通过如下实验来进行。①在盛有稀氢氧化钠溶液的烧杯中,滴加2~3滴酚酞试液,用胶头滴管吸取稀盐酸逐滴加入到上述烧杯中,边滴边用玻璃棒搅拌,当观察到现象时,说明它们之间发生了中和反应,且恰好完全反应。
②将稀盐酸逐滴匀速加入到一定量的稀氢氧化钠溶液中,用数字化仪器对反应过程中溶液的温度、pH进行实时测定,得到的曲线如图1、图2所示。由图1、图2可知,稀盐酸与稀氢氧化钠溶液已发生中和反应的判断依据是 , 溶液pH明显下降直至小于。
(2)、对于某些有明显实验现象产生的中和反应,如稀硫酸与氢氧化钡溶液的反应,只要将稀硫酸滴加到氢氧化钡溶液中,观察到现象,就可说明反应已经发生。该反应的化学方程式是。27. 在老师指导下,小科做了如下实验:点燃燃烧匙上的钠,迅速伸入盛有CO2的集气瓶中,盖上玻片,钠继续燃烧。反应结束后发现:集气瓶内壁附着黑色小颗粒,燃烧匙上黏附着灰白色固体。小科获知灰白色固体中的黑色固体成分是碳,但不清楚其中的白色固体成分是什么,于是进行了如下探究:【提出问题】白色固体的成分是什么?
【建立假设】假设一:白色固体的成分是氧化钠;
假设二:白色固体的成分是碳酸钠;
假设三:白色固体的成分是氧化钠和碳酸钠的混合物。
【进行实验】
步骤1:取燃烧匙上灰白色固体于烧杯中,加入适量的水充分溶解,过滤,得到滤液。
步骤2:取少量步骤1中的滤液于试管中,滴加2滴酚酞试液,溶液变成红色。
【结论】白色固体的成分是氧化钠。
有同学认为通过该实验得出的结论不正确,其理由是。
步骤3:取少量步骤1中的滤液于试管中,滴加足量稀盐酸,溶液中有气泡冒出,结论是。
步骤4:取少量步骤1中的滤液于试管中,加入过量的氯化钙溶液,出现白色沉淀,然后过滤,向所得滤液中滴加酚酞试液,无明显现象。则假设成立。
四、计算题
-
28. 同学们利用如图所示的装置,对质量守恒定律进行了探究。实验结束后,老师另外提出了几个问题,请你一起参与思考。
 (1)、图甲装置内物质充分反应后,冷却至室温,气球仍胀大的是(填“A”“B”或“A和B”)。(2)、若图乙装置内Na2CO3溶液的质量为5克,滴入试管的稀盐酸质量也是5克,装置内物质充分反应后,发现NaOH浓溶液质量增加0.22克,试管中滴入紫色石蕊试液变红。根据上述已知条件,通过分析可以确定的是(填序号)。
(1)、图甲装置内物质充分反应后,冷却至室温,气球仍胀大的是(填“A”“B”或“A和B”)。(2)、若图乙装置内Na2CO3溶液的质量为5克,滴入试管的稀盐酸质量也是5克,装置内物质充分反应后,发现NaOH浓溶液质量增加0.22克,试管中滴入紫色石蕊试液变红。根据上述已知条件,通过分析可以确定的是(填序号)。①原稀盐酸的溶质质量分数
②原Na2CO3溶液的溶质质量分数
③原NaOH溶液的溶质质量分数
④反应后试管中NaCl的溶质质量分数
(3)、请你选择(2)所填的其中一项,通过计算确定其溶质质量分数是多少?