2015-2016学年河南省信阳市高级中学高三下学期开学化学试卷
试卷更新日期:2017-05-02 类型:开学考试
一、选择题
-
1. 研究表明:多种海产品如虾、蟹、牡蛎等,体内含有+5价的砷(As)元素,但它对人体是无毒的,砒霜的成分是As2O3 , 属剧毒物质,专家忠告:吃饭时不要同时大量食用海鲜和青菜,否则容易中毒,并给出了一个公式:大量海鲜+大量维生素C=砒霜.下面有关解释不正确的应该是( )A、青菜中含有维生素C B、维生素C具有还原性 C、致人中毒过程中砷发生还原反应 D、砒霜是氧化产物2. 下列排列顺序正确的是( )
①酸性:H3PO4>H2SO4>HClO4
②热稳定性:H2O>HF>H2S
③原子半径:Na>Mg>O
④还原性:F﹣>Cl﹣>S2﹣
⑤结合H+的能力:OH﹣>CH3COO﹣>Cl﹣ .
A、③⑤ B、②③ C、①③④ D、②④⑤3. 有一真空瓶质量为m1 , 该瓶充入空气后质量为m2 . 在相同状况下,若改为充入某气体A时,总质量为m3 . 则A的相对分子质量是( )A、 B、 C、 D、4. 下列物质中,属于电解质的是( )A、银 B、氯气 C、氯化钠 D、蔗糖溶液5. 气体x可能由NH3、Cl2、H2S、HBr、CO2中的一种或几种组成.已知:x通入AgNO3溶液时产生淡黄色沉淀,该沉淀不溶于稀HNO3;若将x通入澄清石灰水,却不见沉淀产生,则有关气体x的成分,下列说法正确的是( )①一定含有HBr,可能含有CO2 ②一定不含CO2
③一定不含NH3、Cl2、H2S ④可能含有CO2、Cl2 .
A、① B、③ C、①③ D、②③6. Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色.Q元素的原子最外层电子数是其内层电子数的2倍.W、Z最外层电子数相同,Z的核电荷数是W的2倍.元素Y的合金是日常生活中使用最广泛的金属材料之一.下列说法正确的是( )A、原子半径的大小顺序:rx>ry>rW>rq B、X、Y的最高价氧化物的水化物之间不能反应 C、Z、W最外层电子数都为6,最高化合价都为+6价 D、元素Q和Z能形QZ2型的共价化合物7. 有机化合物C4H8是生活中的重要物质,下列关于C4H8的说法中错误的是( )A、C4H8可能是烯烃 B、C4H8中属于烯烃类的同分异构体有4种 C、核磁共振氢谱有2种吸收峰的烯烃结构一定是 D、C4H8中属于烯烃的顺反异构体有2种
8. 标准状况下,1.12L CH4和C2H4的混合气体通入足量溴水中,溴水增重0.28克,则乙烯占混合气体的体积分数为( )A、20% B、40% C、60% D、80%9. 等质量的两块钠,第一块在足量氧气中加热,第二块在足量氧气(常温)中充分反应,则下列说法正确的是( )A、第一块钠失去电子多 B、两块钠失去电子一样多 C、第二块钠的反应产物质量最大 D、两块钠的反应产物质量一样大10. 在常温下将pH=3的某酸溶液跟pH=11的某碱溶液等体积混和后,溶液的pH值( )A、大于7 B、小于7 C、等于7 D、无法确定11. 图是2008年北京奥运会的“祥云”火炬,与悉尼奥运火炬所用主要燃料(丁烷)不同,“祥云”火炬所用燃料为丙烷.丙烷和丁烷的沸点如下表:
D、C4H8中属于烯烃的顺反异构体有2种
8. 标准状况下,1.12L CH4和C2H4的混合气体通入足量溴水中,溴水增重0.28克,则乙烯占混合气体的体积分数为( )A、20% B、40% C、60% D、80%9. 等质量的两块钠,第一块在足量氧气中加热,第二块在足量氧气(常温)中充分反应,则下列说法正确的是( )A、第一块钠失去电子多 B、两块钠失去电子一样多 C、第二块钠的反应产物质量最大 D、两块钠的反应产物质量一样大10. 在常温下将pH=3的某酸溶液跟pH=11的某碱溶液等体积混和后,溶液的pH值( )A、大于7 B、小于7 C、等于7 D、无法确定11. 图是2008年北京奥运会的“祥云”火炬,与悉尼奥运火炬所用主要燃料(丁烷)不同,“祥云”火炬所用燃料为丙烷.丙烷和丁烷的沸点如下表:丙烷
丁烷
沸点/℃
﹣42.6
﹣0.5
下列有关说法中不正确的是( )
 A、丙烷燃烧生成的产物无害,是环保型燃料 B、丙烷的沸点比丁烷低,是因为分子间作用力比丁烷弱 C、丙烷在低温时保持的压力比丁烷大 D、丙烷和丁烷都不存在同分异构体12. 下列反应进行分类时(按初中的方法),既属于氧化反应又属于化合反应的是( )A、Zn+H2SO4═ZnSO4+H2↑ B、2KClO3 2KCl+3O2↑ C、S+O2 SO2 D、H2+Cl2 2HCl13. 由
A、丙烷燃烧生成的产物无害,是环保型燃料 B、丙烷的沸点比丁烷低,是因为分子间作用力比丁烷弱 C、丙烷在低温时保持的压力比丁烷大 D、丙烷和丁烷都不存在同分异构体12. 下列反应进行分类时(按初中的方法),既属于氧化反应又属于化合反应的是( )A、Zn+H2SO4═ZnSO4+H2↑ B、2KClO3 2KCl+3O2↑ C、S+O2 SO2 D、H2+Cl2 2HCl13. 由 转变成
转变成 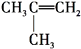 需经过下列合成途径的顺序是( ) A、消去→加成→消去 B、加成→消去→脱水 C、加成→消去→加成 D、取代→消去→加成14. 常温下,若溶液中由水电离产生的c(H+)、c(OH﹣)满足c(H+)•c(OH﹣)=10﹣24 , 则下列各组离子在该溶液中一定可以大量共存的是( )A、Al3+、Na+、NO3﹣、Cl﹣ B、K+、Na+、Cl﹣、NO3﹣ C、K+、Na+、Cl﹣、AlO2﹣ D、K+、NH4+、SO42﹣、NO3﹣15. 某无色溶液中可能含有I﹣、NH4+、Cu2+、SO32﹣ , 向该溶液中加入少量溴水,溶液呈无色,则下列关于溶液组成的判断正确的是( )
需经过下列合成途径的顺序是( ) A、消去→加成→消去 B、加成→消去→脱水 C、加成→消去→加成 D、取代→消去→加成14. 常温下,若溶液中由水电离产生的c(H+)、c(OH﹣)满足c(H+)•c(OH﹣)=10﹣24 , 则下列各组离子在该溶液中一定可以大量共存的是( )A、Al3+、Na+、NO3﹣、Cl﹣ B、K+、Na+、Cl﹣、NO3﹣ C、K+、Na+、Cl﹣、AlO2﹣ D、K+、NH4+、SO42﹣、NO3﹣15. 某无色溶液中可能含有I﹣、NH4+、Cu2+、SO32﹣ , 向该溶液中加入少量溴水,溶液呈无色,则下列关于溶液组成的判断正确的是( )①肯定不含I﹣ ②肯定不含Cu2+ ③肯定含有SO32﹣④可能含有I﹣ .
A、①③ B、①②③ C、③④ D、②③④二、解答题
-
16. 为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去杂质,再与溴水反应.(1)、写出甲同学实验中两个主要的化学方程式:(2)、甲同学设计的实验(填“能”或“不能”)验证乙炔与溴发生加成反应,理由是 .
a.使溴水褪色的反应未必是加成反应
b.使溴水褪色的反应就是加成反应
c.使溴水褪色的物质未必是乙炔
d.使溴水褪色的物质就是乙炔
(3)、乙同学推测此乙炔中必定含有的一种杂质气体是 , 在验证过程中必须全部除去,它与溴水反应的化学方程式是 .17. 某学生用0.100 0mol•L﹣1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:(1)、配制待测液:用2.50g含有少量杂质的固体烧碱样品配制500mL溶液.需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要 .(2)、滴定:Ⅰ.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“0”刻度线以上.
Ⅱ.固定好滴定管并使滴定管尖嘴充满液体,调节液面至“0”或“0”刻度线以下,并记录读数.
Ⅲ.移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液.
Ⅳ.用标准液滴定至终点,记录滴定管液面读数.
①上述滴定步骤中有错误的是(填编号) , 该错误操作会导致测定结果
(填“偏大”“偏小”或“无影响”).
②步骤Ⅳ中滴定时眼睛应 , 判断滴定终点的现象是 .
③若步骤Ⅱ中仰视读数,步骤Ⅳ中俯视读数,则会使测定结果(填“偏大”“偏小”或“无影响”).
(3)、按正确操作测得有关数据记录如下:滴定次数
待测液体积
标准盐酸体积(mL)
滴定前读数(mL)
滴定后读数(mL)
第一次
20.00
0.20
20.38
第二次
20.00
4.00
24.20
第三次
20.00
2.38
a
①a的读数如图所示,则a=;
②烧碱样品的纯度为%.
 18. 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.
18. 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.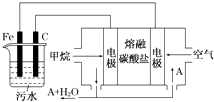 (1)、实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣.此时,应向污水中加入适量的 .A、BaSO4 B、CH3CH2OH C、Na2SO4 D、NaOH(2)、电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是
(1)、实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣.此时,应向污水中加入适量的 .A、BaSO4 B、CH3CH2OH C、Na2SO4 D、NaOH(2)、电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是Ⅰ.;
Ⅱ. .
(3)、电极反应I和Ⅱ的生成物反应得到Fe(OH3)沉淀的离子方程式是 .(4)、该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极.为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图).A物质的化学式是 .19. 1mol锌与足量的稀硫酸反应,求反应后生成的标准状况下的气体的体积为多少升?20. 某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3 , 在一定条件下可实现如图所示的物质之间的变化:
据此回答下列问题:
(1)、Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是 .(2)、根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式沉淀固体B;C;沉淀D;溶液E .
(3)、写出①、②、③、④四个反应方程式①;
②;
③;
④ .
21. 乙酸苯甲酯可用作茉莉、白兰、月下香等香精的调合香料.它可以用甲苯和乙醇为原料进行人工合成.合成路线如下: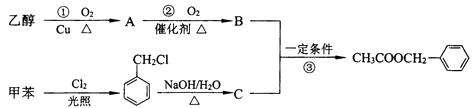 (1)、C的结构简式为 .(2)、反应②、③的反应类型为 , .(3)、甲苯的一氯代物有种.(4)、写出反应①的化学方程式 .(5)、为了提高乙酸苯甲酯的产率应采取的措施是(写一项) .22. 下图表示各物质之间的转化关系.已知:常温下D、E、F、I、J为气体,且D、I是水煤气的主要成分;B是无色液体,M为红褐色固体,C的焰色反应为黄色.
(1)、C的结构简式为 .(2)、反应②、③的反应类型为 , .(3)、甲苯的一氯代物有种.(4)、写出反应①的化学方程式 .(5)、为了提高乙酸苯甲酯的产率应采取的措施是(写一项) .22. 下图表示各物质之间的转化关系.已知:常温下D、E、F、I、J为气体,且D、I是水煤气的主要成分;B是无色液体,M为红褐色固体,C的焰色反应为黄色.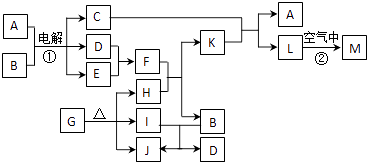 (1)、基于反应①原理的化学工业称为 , 写出该反应的化学方程式 .(2)、写出K和E反应的离子方程式 .
(1)、基于反应①原理的化学工业称为 , 写出该反应的化学方程式 .(2)、写出K和E反应的离子方程式 .写出F溶液和H反应的离子方程式 .
(3)、已知:由G分解得到的H、I、J三者的物质的量之比为1:1:1,则G的化学式为 .23. 根据描述及要求填空:(1)、“纳米材料”是当今材料科学研究的前沿,其研究成果广泛应用于催化及军事科学中.所谓“纳米材料”是指研究、开发出的微粒粒度从几纳米至几十纳米的材料,如将纳米材料分散到分散剂中,所得混合物可能具有的性质是 .A、能全部透过半透膜 B、有丁达尔效应 C、所得液体呈胶状 D、所得物质一定是悬浊液(2)、把淀粉溶液溶于沸水中,制成淀粉胶体,回答下列问题.①鉴别水溶液和胶体可以利用的方法是 .
②60℃ 左右时,在淀粉胶体中加入淀粉酶,装入半透膜袋里,系紧袋口,并把它悬挂在盛有蒸镏水的烧杯里充分反应.从半透膜里析出的物质是 , 该操作的名称是 .
24. A与芳香族化合物B在一定条件下反应生成C,进一步反应生成有机酸D,D的二水合钠盐医学上称之为当归素,是一种治疗偏头痛的有效新药.A的相对分子质量是104,1mol A与足量的NaHCO3反应生成2mol气体.已知:RCHO+CH2(COOH)2 RCH=C(COOH)2+H2O,
RCH=C(COOH)2 RCH=CHCOOH+CO2
 (1)、C可能发生的反应是(填序号).
(1)、C可能发生的反应是(填序号).a.氧化反应 b.水解反应 c.消去反应 d.酯化反应
(2)、等物质的量的C分别与足量的Na、NaHCO3、NaOH反应消耗Na、NaHCO3、NaOH的物质的量之比是 .(3)、E的名称: .(4)、反应①的化学方程式是 .(5)、符合下列条件的D的同分异构体有种,写出其中任意一种的结构简式 .①在苯环上只有两个取代基;②在苯环上的一氯取代物只有两种;
③1mol该同分异构体与足量的NaHCO3反应生2mol CO2 .
25. 已知化学反应①:Fe(s)+CO2(g)═FeO(s)+CO(g),其平衡常数为K1;化学反应②:
Fe(s)+H2O(g)═FeO(s)+H2(g),其平衡常数为K2 . 在温度
973K和1173K情况下,K1、K2的值分别如下:
温度
K1
K2
973K
1.47
2.38
1173K
2.15
1.67
(1)、通过表格中的数值可以推断:反应①是(填“吸热”或“放热”)反应.(2)、现有反应③:CO2(g)+H2(g)=CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3= .(3)、根据反应①与②可推导出K1、K2与K3之间的关系式 . 据此关系式及上表数据,也能推断出反应③是(填“吸热”或“放热”)反应,要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有(填写序号).A.缩小反应容器容积 B.扩大反应容器容积
C.降低温度 D.升高温度
E.使用合适的催化剂 F.设法减少CO的量
(4)、图甲、乙分别表示反应③在t1时刻达到平衡、在t2时刻因改变某个条件而发生变化的情况:①图甲中t2时刻发生改变的条件是 .
②图乙中t2时刻发生改变的条件是 .
