备考2019年高考化学二轮专题 11 非金属及其化合物
试卷更新日期:2019-03-25 类型:二轮复习
一、单选题
-
1. 下列说法正确的是( )A、工业上用氯气与澄清石灰水反应制取漂白粉 B、氯气能与铁反应,所以液氯不宜贮存在钢瓶中 C、漂白粉露置于空气中会变质 D、工业上利用冷却结晶法提取海水中的食盐2. 下列有关硫酸的性质,叙述正确的是( )A、浓硫酸因具有吸水性,所以能使蔗糖炭化 B、实验室用浓硫酸与亚硫酸钠反应制SO2 , 体现浓硫酸的强氧化性 C、常温下,铁遇浓硫酸发生钝化,铁表面生成致密的氧化膜 D、浓硫酸作干燥剂,可以干燥H2、CO2、NH3、Cl2等气体3. 检验下列物质的试剂、现象都正确的是( )
选项
被检验的物质
使用的试剂或方法
实验现象
A
Fe3+
KSCN溶液
溶液出现血红色沉淀
B
SO2
品红溶液
品红溶液褪色,加热不能复原
C
Na+
用铂丝蘸取少量溶液在火焰上灼烧
透过蓝色钴玻璃看到紫色火焰
D
NH4+
NaOH溶液、石蕊试纸
加入NaOH溶液后加热,产生的气体使湿润的红色石蕊试纸变蓝
A、A B、B C、C D、D4. 汽车尾气中的氮氧化合物 与大气中的 发生如下作用,形成一种雾霾。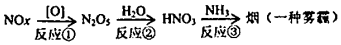
有关该雾霾的叙述错误的是()
A、该雾霾中含硝酸铵固体 B、反应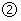 是非氧化还原反应
C、
是非氧化还原反应
C、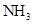 是形成该雾霾的催化剂
D、
是形成该雾霾的催化剂
D、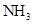 可能来自过度施用氮肥
5. 下列实验装置或操作正确的是( )
可能来自过度施用氮肥
5. 下列实验装置或操作正确的是( )A
B
C
D
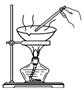
从碘水中分离出碘
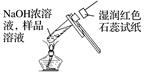
检验溶液中NH4+的存在

干燥SO2气体

收集HCl气体
A、A B、B C、C D、D6. 四支试管中分别充满NO、SO2、NO2、Cl2中的一种,把它们分别倒立于盛有水的水槽中,充分放置后的现象如图所示。其中原试管充满NO2的是( )A、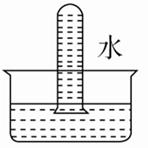 B、
B、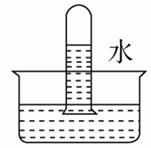 C、
C、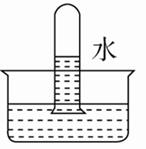 D、
D、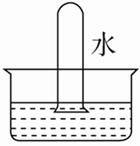 7. 经过多方努力,郑州市的空气质量有明显改善。造成雾霾的重要原因之一是汽车尾气的排放,汽车加装尾气处理装置可以减少有害尾气的排放。在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如下图所示。下列说法错误的是( )
7. 经过多方努力,郑州市的空气质量有明显改善。造成雾霾的重要原因之一是汽车尾气的排放,汽车加装尾气处理装置可以减少有害尾气的排放。在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如下图所示。下列说法错误的是( )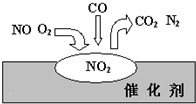 A、NO2是该过程的中间产物 B、汽车尾气的主要污染成分为CO和NO C、NO和O2必须在催化剂表面才能反应 D、该催化转化的总反应方程式:2NO+O2+4CO
A、NO2是该过程的中间产物 B、汽车尾气的主要污染成分为CO和NO C、NO和O2必须在催化剂表面才能反应 D、该催化转化的总反应方程式:2NO+O2+4CO 4CO2+N2
8. 海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。
4CO2+N2
8. 海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。
已知:MgCl2 · 6H2O 受热生成 Mg(OH)Cl 和 HCl 气体等。下列有关说法正确的是( )
A、工业上将石灰水加入到海水中得到 Mg(OH)2 沉淀 B、在过程②中将 MgCl2 · 6H2O 灼烧即可制得无水 MgCl2 C、在第③、④、⑤步骤中,溴元素均被氧化 D、制取 NaHCO3 的反应是利用其溶解度小于 NaCl9. 用图所示实验装置(夹持仪器己略去)探究铜丝与过量浓硫酸的反应.下列实验不合理的是( )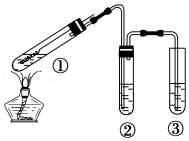 A、上下移动①中铜丝可控制SO2的产生与停止 B、②中选用品红溶液验证SO2的生成 C、③中选用NaOH溶液吸收多余的SO2 D、为确认有CuSO4生成,向①中加水,观察颜色10. 下列有关物质性质的应用正确的是( )A、活泼金属与活泼非金属形成的都是离子键 B、二氧化硅是制造太阳能电池板的主要材料 C、二氧化硫通入酸性KMnO4溶液,溶液紫红色褪去,体现了SO2的漂白性 D、化学反应的实质就是反应物中化学键断裂,生成物中形成新的化学键。11. 下列有关SO2的说法正确的是( )A、SO2和SO3均是酸性氧化物 B、SO2的漂白原理和氯气的漂白原理相同 C、在SO2+2H2S=3S↓+2H2O反应中,氧化产物和还原产物的物质的量之比为1∶2 D、把某气体通入澄清的石灰水中,石灰水变浑浊,该气体一定是SO212. 下列关于硅及其化合物的说法中,正确的是( )A、硅可用于制造光导纤维 B、水泥、玻璃、水晶饰物都是硅酸盐制品 C、可用反应 Na2SiO3+2HCl=2NaCl+H2SiO3(胶体)制取硅酸 D、SiO2既能与HF反应又能与强碱反应,所以SiO2是两性氧化物13. 下列实验能达到预期目的的是( )
A、上下移动①中铜丝可控制SO2的产生与停止 B、②中选用品红溶液验证SO2的生成 C、③中选用NaOH溶液吸收多余的SO2 D、为确认有CuSO4生成,向①中加水,观察颜色10. 下列有关物质性质的应用正确的是( )A、活泼金属与活泼非金属形成的都是离子键 B、二氧化硅是制造太阳能电池板的主要材料 C、二氧化硫通入酸性KMnO4溶液,溶液紫红色褪去,体现了SO2的漂白性 D、化学反应的实质就是反应物中化学键断裂,生成物中形成新的化学键。11. 下列有关SO2的说法正确的是( )A、SO2和SO3均是酸性氧化物 B、SO2的漂白原理和氯气的漂白原理相同 C、在SO2+2H2S=3S↓+2H2O反应中,氧化产物和还原产物的物质的量之比为1∶2 D、把某气体通入澄清的石灰水中,石灰水变浑浊,该气体一定是SO212. 下列关于硅及其化合物的说法中,正确的是( )A、硅可用于制造光导纤维 B、水泥、玻璃、水晶饰物都是硅酸盐制品 C、可用反应 Na2SiO3+2HCl=2NaCl+H2SiO3(胶体)制取硅酸 D、SiO2既能与HF反应又能与强碱反应,所以SiO2是两性氧化物13. 下列实验能达到预期目的的是( )选项
实验目的
实验内容
A
检验溶液中是否含SO42-离子
向溶液中加入稀硝酸酸化的BaCl2溶液,观察是否有沉淀生成
B
检验溶液中是否含NH4+
向盛有该溶液的试管中加入NaOH固体,加热,在试管口放置湿润的淀粉KI试纸,观察试纸是否变蓝
C
证明Na2O2与CO2是放热反应
用脱脂棉包裹Na2O2 , 放入充满CO2的集气
瓶中,观察棉花是否燃烧
D
证明Na与水反应有碱性物质生成
取金属Na,用滤纸将其表面的煤油吸干,切下黄豆大小的Na,小心放入盛有适量水的烧杯中,观察是否有气体生成
A、A B、B C、C D、D14. 以下物质间的每步转化通过一步反应能实现的是( )A、Al→Al2O3→Al(OH)3→NaAlO2 B、Si→SiO2→H2SiO3→Na2SiO3 C、S→SO3→H2SO4→MgSO4 D、Na→Na2O2→Na2CO3→NaOH15. 鉴别稀硫酸和浓硫酸既简单又安全的方法是( )A、各取少量于试管中加入几片铜片 B、用玻璃棒各蘸少许点在滤纸上 C、各取少量于试管中滴加NaOH溶液 D、各取少量于试管中滴加BaCl2溶液16. 一定条件下,下列各组物质能一步实现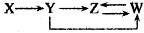 转化关系的是( )
转化关系的是( ) 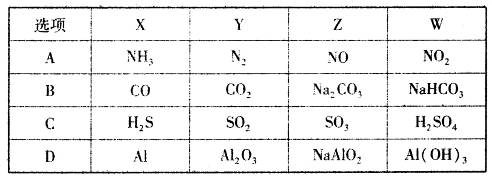 A、A B、B C、C D、D17. 工业上以某软锰矿(主要成分为MnO2 , 还含有SiO2、Al2O3等杂质)为原料,利用烟道气中的SO2制备MnSO4·H2O的流程如下:
A、A B、B C、C D、D17. 工业上以某软锰矿(主要成分为MnO2 , 还含有SiO2、Al2O3等杂质)为原料,利用烟道气中的SO2制备MnSO4·H2O的流程如下: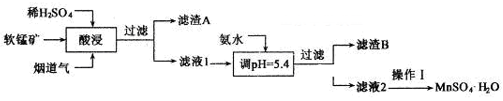
下列说法错误的是( )
A、滤渣A的主要成分能导电,可制备光导纤维 B、“酸浸”主要反应的离子方程式为MnO2+SO2=Mn2++SO42- C、加氨水调节pH的目的是除Al3+ D、操作I为结晶、过滤、洗涤、干燥18. 检验某溶液中是否含有SO42-时,为防止Ag+、CO32-、SO32-等离子的干扰,下列实验方案比较严密的是( )A、先加稀HCl将溶液酸化,再滴加BaCl2溶液,看是否生成白色沉淀; B、先加稀HNO3将溶液酸化,再滴加BaCl2溶液,看是否生成白色沉淀; C、向溶液中滴加稀盐酸酸化的BaCl2溶液,看是否生成白色沉淀; D、向溶液中滴加稀硝酸酸化的BaCl2溶液,看是否生成白色沉淀;19. 已知某厂排放的尾气中NO、NO2的体积比为1:1,该厂采用NaOH溶液来处理该尾气,处理后所得溶液中只有一种含氮的钠盐。则该含氮的钠盐中,氮元素的化合价为( )A、-3 B、+1 C、+3 D、+520. 某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2 , 排尽装置内的空气。
已知:在溶液中,FeSO4+NO [Fe(NO)]SO4(棕色),该反应可用于检验NO。下列对该实验相关描述错误的是( )
A、装置F、I中的试剂依次为水,硫酸亚铁溶液 B、装置J收集的气体中不含NO C、实验结束后,先熄灭酒精灯,再关闭分液漏斗的活塞 D、若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应二、综合题
-
21. 实验室用下图装置(夹持及加热仪器已略)制备氯气并进行相关实验。
 (1)、实验室常用A装置制取氯气,写出实验室制取氯气的化学方程式;(2)、装置B中饱和食盐水的作用是;(3)、装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入;
(1)、实验室常用A装置制取氯气,写出实验室制取氯气的化学方程式;(2)、装置B中饱和食盐水的作用是;(3)、装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入;Ⅰ
Ⅱ
Ⅲ
a
干燥的有色布条
碱石灰
湿润的有色布条
b
干燥的有色布条
无水氯化钙
湿润的有色布条
c
湿润的有色布条
浓硫酸
干燥的有色布条
d
湿润的有色布条
无水氯化钙
干燥的有色布条
(4)、装置D的作用是尾气处理,写出烧杯中发生的反应化学方程式;(5)、实验室常用湿润的KI淀粉试纸检验氯气,写出氯气与KI发生反应的化学方程式。22. A,B,C,D均为中学化学常见物质,且均含有同一种元素,其中A是单质,它们之间存在如图转化关系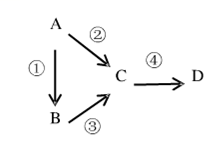 (1)、Ⅰ.若D是红棕色气体;B气体溶于水后,溶液为碱性。
(1)、Ⅰ.若D是红棕色气体;B气体溶于水后,溶液为碱性。请写出A的化学式 , 反应③的化学反应方程式为。
(2)、D溶于水形成的稀溶液与铜反应的离子方程式为 , 该反应的实验现象为(写出两条)。(3)、Ⅱ若B、D既能与强酸溶液反应,又能与强碱溶液反应,反应②③均为强酸条件。反应④可以通过滴加氨水实现,该反应的离子方程式为。
(4)、请写出A用于焊接铁轨的化学方程式。三、推断题
-
23. 中学化学中的一些常见物质有如图转化关系。其中A、H为空气中的主要成分,气体B能使湿润的红色石蕊试纸变蓝,气体D遇到A很快变成红棕色E,C属于氧化物,I是紫红色金属单质。X为常见液体(部分反应条件及生成物没有全部列出)。

回答下列问题。
(1)、C的化学式为。(2)、X的电子式为。(3)、写出反应①的化学方程式。(4)、写出反应②的离子方程式。