备考2019年高考化学二轮专题 10 金属及其化合物
试卷更新日期:2019-03-25 类型:二轮复习
一、单选题
-
1. 下列说法不正确的是( )A、铜呈紫红色,可与氯化铁溶液反应制作印刷电路板 B、工业上用焦炭在高温下还原二氧化硅可直接得到高纯度的硅 C、可用丁达尔效应区分胶体和溶液 D、镁合金大量用于制造火箭、导弹和飞机的部件2. 现在有混有少量碳酸氢钠的碳酸钠固体,下列有关提纯碳酸钠的方法中,正确的是( )A、加入过量的氢氧化钠溶液 B、加入适量的盐酸 C、将固体充分加热,直到质量不变为止 D、加入氯化钙溶液3. 氧化钠与过氧化钠的共同之处是( )A、都是淡黄色固体 B、都能与水作用生成碱 C、都是碱性氧化物 D、氧元素的化合价都是-2价4. 将一定质量的Mg和Al混合物投入500mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如下图所示。则下列说法正确的是( )
 A、NaOH溶液的物质的量浓度为5mol·L-1 B、Mg和Al的总质量为8g C、硫酸的物质的量浓度为5mol·L-1 D、生成的H2在标准状况下的体积为11.2L5. 将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的 CO2(标准状况)与加入的盐酸的体积有如图所示的关系(不考虑 CO2 在水中的溶解)。下列说法不正确的是( )
A、NaOH溶液的物质的量浓度为5mol·L-1 B、Mg和Al的总质量为8g C、硫酸的物质的量浓度为5mol·L-1 D、生成的H2在标准状况下的体积为11.2L5. 将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的 CO2(标准状况)与加入的盐酸的体积有如图所示的关系(不考虑 CO2 在水中的溶解)。下列说法不正确的是( ) A、滴加盐酸 0→150mL 段发生的反应依次为 OH-+H+=H2O CO32-+H+=HCO3- B、所用盐酸的物质的量浓度为 0.4 mol•L﹣1 C、CO2体积不再改变时,溶液中的溶质为 NaCl D、该样品中 NaOH 与 Na2CO3 物质的量之比为1:26. 下列金属冶炼的反应原理,错误的是( )A、高炉炼铁:Fe2O3 + 3CO
A、滴加盐酸 0→150mL 段发生的反应依次为 OH-+H+=H2O CO32-+H+=HCO3- B、所用盐酸的物质的量浓度为 0.4 mol•L﹣1 C、CO2体积不再改变时,溶液中的溶质为 NaCl D、该样品中 NaOH 与 Na2CO3 物质的量之比为1:26. 下列金属冶炼的反应原理,错误的是( )A、高炉炼铁:Fe2O3 + 3CO 2Fe + 3CO2
B、火法炼铜:Cu2S+O2
2Fe + 3CO2
B、火法炼铜:Cu2S+O2  2Cu+SO2
C、铝的冶炼:Al2O3+3H2
2Cu+SO2
C、铝的冶炼:Al2O3+3H2  2Al+3H2O
D、铝热法炼铁:Fe2O3+2Al
2Al+3H2O
D、铝热法炼铁:Fe2O3+2Al  2Fe +Al2O3
7. 甲是一种常见的单质,乙、丙为中学常见的化合物,甲、乙、丙均含有元素 X 。它们有如下的转化关系(部分产物及反应条件已略去),下列判断正确的是( )
2Fe +Al2O3
7. 甲是一种常见的单质,乙、丙为中学常见的化合物,甲、乙、丙均含有元素 X 。它们有如下的转化关系(部分产物及反应条件已略去),下列判断正确的是( ) A、X元素可能为Al B、X 元素不一定为非金属元素 C、反应①和②互为可逆反应 D、反应①和②一定为氧化还原反应8. 以下物质之间的每步转化中,都能通过一步实现的是( )
A、X元素可能为Al B、X 元素不一定为非金属元素 C、反应①和②互为可逆反应 D、反应①和②一定为氧化还原反应8. 以下物质之间的每步转化中,都能通过一步实现的是( )① Fe→FeCl2→Fe(OH)2→Fe(OH)3
② Na→Na2O→Na2CO3→NaHCO3→NaOH
③ Mg→MgCl2→Mg(OH)2
④ Al→Al2O3→Al(OH)3
⑤ Al→NaAlO2→Na2CO3
A、②③④ B、①③④⑤ C、①②③⑤ D、①②③④⑤9. 下图模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )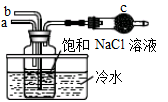 A、a先通入CO2 , 然后b通入NH3 , c中放碱石灰 B、b先通入NH3 , 然后a通入CO2 , c中放碱石灰 C、a先通入NH3 , 然后b通入CO2 , c中放蘸稀硫酸的脱脂棉 D、b先通入CO2 , 然后a通入NH3 , c中放蘸稀硫酸的脱脂棉10. 向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/LBa(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法错误的是( )
A、a先通入CO2 , 然后b通入NH3 , c中放碱石灰 B、b先通入NH3 , 然后a通入CO2 , c中放碱石灰 C、a先通入NH3 , 然后b通入CO2 , c中放蘸稀硫酸的脱脂棉 D、b先通入CO2 , 然后a通入NH3 , c中放蘸稀硫酸的脱脂棉10. 向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/LBa(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法错误的是( ) A、原混合液中c(SO42-):c(Cl-)=1:1 B、向D点溶液中通入C02气体,立即产生白色沉淀 C、图中A点沉淀中含有BaSO4和Al(OH)3 D、AB段反应的离子方程式为:Al3++3OH-=Al(OH)3↓11. 由CO和H2组成的混合气体2.4g在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na2O2固体,Na2O2固体增加的质量为( )A、1.2g B、2.4 g C、3.6g D、无法计算12. 将钠投入下列溶液中,既有气体产生,又有沉淀生成的是( )A、NaCl溶液 B、FeCl3溶液 C、盐酸 D、Na2CO3溶液13. 一定能实现铁元素之间相互转化的措施是( )
A、原混合液中c(SO42-):c(Cl-)=1:1 B、向D点溶液中通入C02气体,立即产生白色沉淀 C、图中A点沉淀中含有BaSO4和Al(OH)3 D、AB段反应的离子方程式为:Al3++3OH-=Al(OH)3↓11. 由CO和H2组成的混合气体2.4g在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na2O2固体,Na2O2固体增加的质量为( )A、1.2g B、2.4 g C、3.6g D、无法计算12. 将钠投入下列溶液中,既有气体产生,又有沉淀生成的是( )A、NaCl溶液 B、FeCl3溶液 C、盐酸 D、Na2CO3溶液13. 一定能实现铁元素之间相互转化的措施是( ) A、实现①的转化,用比铁活泼的金属 B、实现②的转化,通过钢铁电化腐蚀 C、实现③的转化,加入少量稀硝酸 D、实现④的转化,加入过量氯气14. 向含1mol HCl和1mol MgSO4的混合溶液中加入1mol/L Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图是( )A、
A、实现①的转化,用比铁活泼的金属 B、实现②的转化,通过钢铁电化腐蚀 C、实现③的转化,加入少量稀硝酸 D、实现④的转化,加入过量氯气14. 向含1mol HCl和1mol MgSO4的混合溶液中加入1mol/L Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图是( )A、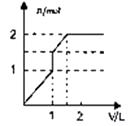 B、
B、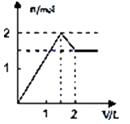 C、
C、 D、
D、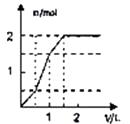
二、解答题
-
15. 如图图象中,纵坐标为沉淀物的物质的量,横坐标为向溶液中加入反应物的物质的量,则相应的图象序号与(1)﹣(4)对应的是

溶液
加入物质
对应的图象
⑴饱和石灰水
通过量CO2气体
⑵氯化铝溶液
加入过量氨水
⑶MgCl2、AlCl3的混合液
逐滴加入NaOH溶液至过量
⑷含少量NaOH的NaAlO2溶液
逐滴加入稀盐酸
三、综合题
-
16. 小块用铝箔包着的钠投入装有足量水的试管中。(1)、写出在装置中发生化学反应的离子方程式:。(2)、若 Na 与 Al 混合物共 1 mol 与足量的水的充分反应。
①当 Na 与 Al 的物质的量之比为时,混合物与水产生的 H2 最多。
②当 Na 与 Al 的物质的量之比为时,混合物与水反应产生的 H2 的体积为 13.44 L(标准状况下)。
17. 某工厂的工业硫酸盐废水中含有大量的Fe2+、Fe3+、较多的Cu2+和少量的Na+。工厂计划从该废水中回收硫酸亚铁和金属铜,设计如下流程图。
回答下列问题;
(1)、A的化学式为 , D的化学式为。(2)、在工业废水中加入过量A时,发应的离子方程式有:、。(3)、得到FeSO4•7H2O晶体的操作Ⅲ为:加热浓缩、冷却结晶、、、干燥。18.(1)、用FeSO4·7H2O配制FeSO4溶液时,需加入稀H2SO4和。(2)、在过量FeSO4溶液中滴入稀硫酸,再滴入几滴H2O2溶液,溶液立即变黄。上述反应的离子方程式为。(3)、为检验上述反应中的氧化产物,甲同学取少许上述反应后的溶液,加入 , 出现血红色溶液,证明氧化产物为Fe3+;乙同学取少许上述反应后的溶液,加入溶液,溶液变蓝,证明氧化产物为Fe3+ , 该反应的离子方程式为。(4)、为证明上述反应后的溶液中仍存在过量的Fe2+ , 可向其中滴加溶液。19. 2017年3月21日是第二十五届“世界水日”,保护水资源,合理利用废水节省水资源,加强废水的回收利用已被越来越多的人所关注。已知:某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3¯、CO32¯、SO42¯中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关图像如下所示:
请回答下列问题:
(1)、根据上述3组实验可以分析废水中一定不存在的阴离子是 , 一定存在的阳离子是。(2)、写出实验③图像中沉淀开始减少至完全消失阶段发生反应的离子反应方程式:。(3)、分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为 , 所得沉淀的最大质量是g。(4)、若通过实验确定原废水中c(Na+)=0.14 mol·L¯1 , 试判断原废水中NO3¯是否存在?(填“存在”“不存在”或“不确定”)。若存在,c(NO3¯)=mol·L¯1。(若不存在或不确定则此空不填)四、推断题
-
20. 已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀,W溶液中滴加KSCN溶液出现血红色。
 (1)、物质A的化学式为 , F化学式为 ;(2)、B和R在溶液中反应生成F的离子方程式为;(3)、H在潮湿空气中变成M的实验现象是 , 化学方程式为;(4)、A和水反应生成B和C的化学方程式为 , 由此反应可知A有作为的用途;(5)、W溶液中滴加KSCN溶液出现血红色的离子方程式。21.(1)、I.A、B、C、D四种均为含有钠元素的化合物,A、B、C与盐酸反应均可生成D;加热固体C可生成A和一种无色无味的气体X;在A溶液中通入足量X,又可生成C;B溶液和C溶液混合可生成A。请回答:
(1)、物质A的化学式为 , F化学式为 ;(2)、B和R在溶液中反应生成F的离子方程式为;(3)、H在潮湿空气中变成M的实验现象是 , 化学方程式为;(4)、A和水反应生成B和C的化学方程式为 , 由此反应可知A有作为的用途;(5)、W溶液中滴加KSCN溶液出现血红色的离子方程式。21.(1)、I.A、B、C、D四种均为含有钠元素的化合物,A、B、C与盐酸反应均可生成D;加热固体C可生成A和一种无色无味的气体X;在A溶液中通入足量X,又可生成C;B溶液和C溶液混合可生成A。请回答:①B是 , D是 , (均用化学式表示)
②写出上述反应中由A生成C的化学方程式:。
(2)、II.化合物甲仅含两种元素。B为黄绿色气体,气体D能使湿润的红色石蕊试纸变蓝色。在一定条件下有如下转化关系:
请回答:
①化合物甲所含元素为(填写元素符号),甲的化学式为。
②气体B与水反应的离子方程式为。
③甲与水反应的化学方程式为。
-