浙江省绍兴市诸暨市2018-2019学年高三上学期化学期末考试试卷
试卷更新日期:2019-03-21 类型:期末考试
一、单选题
-
1. 下列属于盐的是()A、Na2CO3 B、MgO C、NaOH D、CH42. 下列图示与操作名称不对应的是()A、洗气
 B、过滤
B、过滤  C、加热蒸发
C、加热蒸发  D、分液
D、分液  3. 下列属于非电解质的是()A、金属铜 B、浓硫酸 C、氨气 D、水4. 下列物质的水溶液,滴入酚酞可能变红的是()A、CH3COONa B、NH4Cl C、NaCl D、NaHSO45. 下列属于物理变化的是()A、煤的气化 B、石油裂化 C、石油分馏 D、橡胶老化6. 下列说法正确的是()A、海水中提取镁的工业流程中,涉及到置换反应 B、侯氏制碱工业是以氯化钠为主要原料,制得大量NaOH C、我国华为AI芯片已跻身于全球AI芯片榜单前列,该芯片的主要材料是二氧化硅 D、垃圾分类是化废为宝的重要举措,厨余垃圾可用来制沼气或堆肥7. 下列变化过程,需要加入还原剂才能实现的是()A、Fe
3. 下列属于非电解质的是()A、金属铜 B、浓硫酸 C、氨气 D、水4. 下列物质的水溶液,滴入酚酞可能变红的是()A、CH3COONa B、NH4Cl C、NaCl D、NaHSO45. 下列属于物理变化的是()A、煤的气化 B、石油裂化 C、石油分馏 D、橡胶老化6. 下列说法正确的是()A、海水中提取镁的工业流程中,涉及到置换反应 B、侯氏制碱工业是以氯化钠为主要原料,制得大量NaOH C、我国华为AI芯片已跻身于全球AI芯片榜单前列,该芯片的主要材料是二氧化硅 D、垃圾分类是化废为宝的重要举措,厨余垃圾可用来制沼气或堆肥7. 下列变化过程,需要加入还原剂才能实现的是()A、Fe Fe2+
B、SO2
Fe2+
B、SO2  S
C、NH4+
S
C、NH4+  NH3
D、KMnO4
NH3
D、KMnO4  O2
8. 下列表示正确的是()A、
O2
8. 下列表示正确的是()A、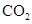 的电子式:
的电子式:  B、乙醛的结构简式:
B、乙醛的结构简式:  C、乙炔的比例模型:
C、乙炔的比例模型:  D、氟离子的结构示意图:
D、氟离子的结构示意图:  9. 下列物质能与水反应产生氢气的是()A、氯酸钾 B、二氧化硅 C、金属钠 D、氯气10. 下列说法正确的是()A、可用NaOH溶液鉴别碳酸钠和碳酸氢钠两种稀溶液 B、可用分液的方法除去乙酸乙酯中的乙酸 C、可用品红溶液鉴别三氧化硫和二氧化硫 D、可用丁达尔现象区分淀粉溶液和氢氧化铁胶体11. 下列说法错误的是()A、C6H14所有的同分异构体中主链为4个碳的只有2种 B、CH3CO18OCH2CH3在酸性条件下水解能得到CH3CH218OH C、
9. 下列物质能与水反应产生氢气的是()A、氯酸钾 B、二氧化硅 C、金属钠 D、氯气10. 下列说法正确的是()A、可用NaOH溶液鉴别碳酸钠和碳酸氢钠两种稀溶液 B、可用分液的方法除去乙酸乙酯中的乙酸 C、可用品红溶液鉴别三氧化硫和二氧化硫 D、可用丁达尔现象区分淀粉溶液和氢氧化铁胶体11. 下列说法错误的是()A、C6H14所有的同分异构体中主链为4个碳的只有2种 B、CH3CO18OCH2CH3在酸性条件下水解能得到CH3CH218OH C、 的名称是2-甲基-2-乙基丙烷
D、
的名称是2-甲基-2-乙基丙烷
D、 与
与  是同一种物质
12. X、Y、Z、M四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是( )
是同一种物质
12. X、Y、Z、M四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是( ) A、原子半径:M>Z>Y>X B、Z的气态氢化物最稳定,因其分子间存在氢键 C、最高价氧化物对应水化物的酸性M<Z D、元素的非金属性:X<Y<Z13. 下列离子方程式错误的是()A、少量SO2气体通入次氯酸钠溶液中:SO2+3ClO-+H2O=SO42-+Cl-+2HClO B、氧化铁溶于HI溶液:Fe2O3+6H+=2Fe3++3H2O C、碳酸氢钠与过量Ba(OH)2溶液反应:HCO3-+OH-+Ba2+=BaCO3
A、原子半径:M>Z>Y>X B、Z的气态氢化物最稳定,因其分子间存在氢键 C、最高价氧化物对应水化物的酸性M<Z D、元素的非金属性:X<Y<Z13. 下列离子方程式错误的是()A、少量SO2气体通入次氯酸钠溶液中:SO2+3ClO-+H2O=SO42-+Cl-+2HClO B、氧化铁溶于HI溶液:Fe2O3+6H+=2Fe3++3H2O C、碳酸氢钠与过量Ba(OH)2溶液反应:HCO3-+OH-+Ba2+=BaCO3 +H2O
D、向硅酸钠水溶液中通入过量CO2气体:SiO32-+2H2O+2CO2=2HCO3-+H2SiO3
+H2O
D、向硅酸钠水溶液中通入过量CO2气体:SiO32-+2H2O+2CO2=2HCO3-+H2SiO3  14. 一定温度下,在某体积固定的密闭容器中加入2molA和1molB,发生可逆反应2A(g)+B(g) 3C(g) ΔH=-akJ/mol,下列说法正确的是()A、当容器内压强不变时说明反应已达到平衡 B、当反应达到平衡时c(A):c(B):c(C)=1:2:3 C、当反应达到平衡时放出热量akJ D、其他条件不变,升高温度反应速率加快15. 下列说法正确的是()A、乙烷和乙烯都能用来制取氯乙烷,且反应类型相同 B、无水乙醇比医用酒精的消毒效果更好 C、除去甲烷的乙烯可通过酸性高锰酸钾溶液洗气 D、甲苯和乙苯都是苯的同系物16. 下列说法正确的是()A、油脂的水解和蛋白质的变性都是物理变化 B、纤维素和淀粉的化学式相同,两者互为同分异构体 C、羊毛和蚕丝的主要成分均为蛋白质,是天然高分子化合物 D、甘氨酸和丙氨酸通过缩合反应最多可以得到三种二肽17. 2017年4月,中国科学院长春应用化学研究所研究员张新波课题组提出并论证了基于反应6Li+N2 2Li3N,通过Li-N2可充电电池直接利用空气中的氮气实现人工固氮的可能性。电Li-N2池的结构如图所示,电解液为LiCF3SO3。下列说法正确的是()
14. 一定温度下,在某体积固定的密闭容器中加入2molA和1molB,发生可逆反应2A(g)+B(g) 3C(g) ΔH=-akJ/mol,下列说法正确的是()A、当容器内压强不变时说明反应已达到平衡 B、当反应达到平衡时c(A):c(B):c(C)=1:2:3 C、当反应达到平衡时放出热量akJ D、其他条件不变,升高温度反应速率加快15. 下列说法正确的是()A、乙烷和乙烯都能用来制取氯乙烷,且反应类型相同 B、无水乙醇比医用酒精的消毒效果更好 C、除去甲烷的乙烯可通过酸性高锰酸钾溶液洗气 D、甲苯和乙苯都是苯的同系物16. 下列说法正确的是()A、油脂的水解和蛋白质的变性都是物理变化 B、纤维素和淀粉的化学式相同,两者互为同分异构体 C、羊毛和蚕丝的主要成分均为蛋白质,是天然高分子化合物 D、甘氨酸和丙氨酸通过缩合反应最多可以得到三种二肽17. 2017年4月,中国科学院长春应用化学研究所研究员张新波课题组提出并论证了基于反应6Li+N2 2Li3N,通过Li-N2可充电电池直接利用空气中的氮气实现人工固氮的可能性。电Li-N2池的结构如图所示,电解液为LiCF3SO3。下列说法正确的是() A、b极为电池的负极 B、电池放电时Li+移向a极 C、b极的电极方程式为N2+6Li++6e-=2Li3N D、金属锂在放电过程中发生还原反应18. 现有室温下pH=12的两种溶液:①氨水②氢氧化钠溶液,下列说法正确的是()A、两溶液的物质的量浓度均为0.01mol/L B、两溶液中c(NH4+)=c(Na+) C、取等体积的两溶液分别与同浓度的盐酸恰好完全反应,消耗盐酸的体积①<② D、分别稀释到pH=10,两溶液所加蒸馏水的体积:②>①19. 下列说法正确的是()A、硫酸钠溶液的导电过程发生了化学变化 B、由于SiO2的分子间作用力比CO2大,导致SiO2的熔点比CO2高 C、氢与其它元素只能形成共价化合物 D、强电解质都是离子化合物20. 设NA为阿伏加德罗常数的值,下列说法正确的是()A、将1molN2和3molH2置于密闭容器中充分反应,形成N-H键的数目为6NA B、22.4LD2中含有的中子数目为2NA C、7.8gNa2O2中含有的离子数为0.4NA D、常温常压下,1mol氯气与足量的NaOH溶液完全反应转移电子数为NA21. 由合成气制备二甲醚,涉及如下反应:
A、b极为电池的负极 B、电池放电时Li+移向a极 C、b极的电极方程式为N2+6Li++6e-=2Li3N D、金属锂在放电过程中发生还原反应18. 现有室温下pH=12的两种溶液:①氨水②氢氧化钠溶液,下列说法正确的是()A、两溶液的物质的量浓度均为0.01mol/L B、两溶液中c(NH4+)=c(Na+) C、取等体积的两溶液分别与同浓度的盐酸恰好完全反应,消耗盐酸的体积①<② D、分别稀释到pH=10,两溶液所加蒸馏水的体积:②>①19. 下列说法正确的是()A、硫酸钠溶液的导电过程发生了化学变化 B、由于SiO2的分子间作用力比CO2大,导致SiO2的熔点比CO2高 C、氢与其它元素只能形成共价化合物 D、强电解质都是离子化合物20. 设NA为阿伏加德罗常数的值,下列说法正确的是()A、将1molN2和3molH2置于密闭容器中充分反应,形成N-H键的数目为6NA B、22.4LD2中含有的中子数目为2NA C、7.8gNa2O2中含有的离子数为0.4NA D、常温常压下,1mol氯气与足量的NaOH溶液完全反应转移电子数为NA21. 由合成气制备二甲醚,涉及如下反应:(i)2CH3OH(g) C2H4(g)+2H2O(g) ΔH1
(ii)2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2
能量变化如图所示:

下列说法正确的是( )
A、ΔH1<ΔH2 B、反应(ii)为吸热反应 C、C2H4(g)+H2O(g) CH3OCH3(g) ΔH=-5.2kJ·mol-1
D、若在容器中加入催化剂,则E2-E1将变小
22. 在一定温度下,10mL4.0mol/LH2O2发生分解:2H2O2 H2O+O2 ,不同时刻测定生成O2的体积(已折算为标准状况)如下表:
CH3OCH3(g) ΔH=-5.2kJ·mol-1
D、若在容器中加入催化剂,则E2-E1将变小
22. 在一定温度下,10mL4.0mol/LH2O2发生分解:2H2O2 H2O+O2 ,不同时刻测定生成O2的体积(已折算为标准状况)如下表:t/min
0
2
4
6
8
10
V(O2)/mL
0.0
9.9
17.2
22.4
26.5
29.9
下列叙述正确的是(溶液体积变化忽略不计)( )
A、6 min时反应速率υ(H2O2)=3.33×10-2mol/(L·mol) B、反应到6min时,H2O2分解率为50% C、其他条件不变,若换用更高效的催化剂,达到平衡时将会得到更多氧气 D、随时间增长得到的氧气更多,说明反应速率逐渐加快23. 常温下,将NaOH溶液滴加到某一元酸(HA)溶液中,测得混合溶液的pH与离子浓度变化关系如下图所示[已知: ]。下列叙述错误的是() A、Ka(HA)=10-4.76 B、滴加NaOH溶液过程中,
A、Ka(HA)=10-4.76 B、滴加NaOH溶液过程中, 保持不变
C、m点所示溶液中:c(H+)=c(HA)+c(OH-)-c(Na+)
D、n点所示溶液中可能:c((Na+)=c(A-)+c(HA)
24. 已知矿石Cu5FeS4在空气中高温煅烧可得Fe2O3和CuO的固体混合物和一种能使酸性KMnO4溶液褪色的气体,下列说法正确的是()A、该气体能使酸性KMnO4溶液褪色,体现了该气体具有漂白性 B、所得气体使酸性KMnO4溶液褪色的离子方程式为:5SO2+2MnO4-+2H2O= 5SO42-+2Mn2++4H+ C、将所得气体通入硝酸酸化的BaCl2溶液能产生不溶于硝酸的白色沉淀,说明所得气体中一定含有SO3 D、将所得固体溶于稀硫酸,再向溶液中加入一定量铁粉,一定会有红色的铜析出25. 下列化学实验事实及其解释或结论都正确的是()A、取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ B、向1 mL 1%的NaOH溶液中加入2mL2%的CuSO4溶液,振荡后再加入0.5mL有机物X,加热后未出现砖红色沉淀,说明X中不含有醛基 C、向CuSO4溶液中加入KI溶液,有白色沉淀生成;再加入四氯化碳振荡,四氯化碳层呈紫色,白色沉淀可能为CuI D、某待测溶液可能含有等浓度的下列离子中的若干种K+、Na+、NH4+、Mg2+、Fe2+、Fe3+、I-、CO32-、SO42-。现取少量待测溶液于试管,加入足量NaOH溶液得到白色沉淀,加热产生无色气体,则原溶液中是否含有K+、Na+ , 需通过焰色反应确定。
保持不变
C、m点所示溶液中:c(H+)=c(HA)+c(OH-)-c(Na+)
D、n点所示溶液中可能:c((Na+)=c(A-)+c(HA)
24. 已知矿石Cu5FeS4在空气中高温煅烧可得Fe2O3和CuO的固体混合物和一种能使酸性KMnO4溶液褪色的气体,下列说法正确的是()A、该气体能使酸性KMnO4溶液褪色,体现了该气体具有漂白性 B、所得气体使酸性KMnO4溶液褪色的离子方程式为:5SO2+2MnO4-+2H2O= 5SO42-+2Mn2++4H+ C、将所得气体通入硝酸酸化的BaCl2溶液能产生不溶于硝酸的白色沉淀,说明所得气体中一定含有SO3 D、将所得固体溶于稀硫酸,再向溶液中加入一定量铁粉,一定会有红色的铜析出25. 下列化学实验事实及其解释或结论都正确的是()A、取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ B、向1 mL 1%的NaOH溶液中加入2mL2%的CuSO4溶液,振荡后再加入0.5mL有机物X,加热后未出现砖红色沉淀,说明X中不含有醛基 C、向CuSO4溶液中加入KI溶液,有白色沉淀生成;再加入四氯化碳振荡,四氯化碳层呈紫色,白色沉淀可能为CuI D、某待测溶液可能含有等浓度的下列离子中的若干种K+、Na+、NH4+、Mg2+、Fe2+、Fe3+、I-、CO32-、SO42-。现取少量待测溶液于试管,加入足量NaOH溶液得到白色沉淀,加热产生无色气体,则原溶液中是否含有K+、Na+ , 需通过焰色反应确定。二、推断题
-
26. 以石油和淀粉或纤维素为原料均可制得乙酸乙酯,转化关系如下图:

其中气体B在标况下的密度为:1.25 g/L。请回答:
(1)、B中官能团的名称是。(2)、A的分子式是。(3)、反应④的化学方程式为。(4)、下列说法正确的是________。A、反应②⑤⑥属于取代反应 B、物质F的结构简式为CH3CH2OOCCH3 C、B和E可在一定条件下直接合成F,该方法符合绿色化学理念 D、可用新制氢氧化铜鉴别C、D、E三种物质27. 化合物A由三种元素组成,某兴趣小组进行了如下实验:
已知:气体甲为纯净物且只含两种元素,在标况下体积为672 mL;溶液乙为建筑行业中常用的粘合剂。
请回答下列问题:
(1)、A的组成元素为(用元素符号表示);(2)、写出气体甲与NaOH(aq)反应的离子方程式;(3)、高温下,A与足量氯气能发生剧烈爆炸,生成三种常见化合物试写出相应的化学方程式。28. 马来酸氯苯那敏又名扑尔敏( )是一种常见的抗过敏药物,其合成路线如下:
)是一种常见的抗过敏药物,其合成路线如下: 
已知:碳碳双键可以被臭氧氧化

请回答下列问题:
(1)、下列说法中错误的是________。A、扑尔敏的分子式为C16H18N2Cl B、G分子中含有两个手性碳原子 C、化合物C中所有原子可能共平面 D、化合物E能发生取代、加成、氧化、还原反应(2)、化合物B的结构简式是。(3)、E F的化学方程式是。(4)、写出同时符合下列条件的化合物B(C12H12N2)两个同分异构体的结构简式。①分子中含有两个六元环;②1H-NMR谱显示有3个峰。
(5)、设计由D经两步反应得到E的合成路线(用流程图表示,无机试剂任选)。三、实验题
-
29. 乙酸乙酯广泛用于药物、染料、香料等工业,其制备原理为: 甲、乙两同学分别设计了如下装置来制备乙酸乙酯。
甲
 乙
乙 
请回答下列问题:
(1)、下列说法错误的是________。A、加入试剂的顺序依次为乙醇、浓硫酸、乙酸 B、饱和碳酸钠的作用是中和乙酸、溶解乙醇、促进乙酸乙酯在水中的溶解 C、浓硫酸在反应中作催化剂和吸水剂,加入的量越多对反应越有利 D、反应结束后,将试管中收集到的产品倒入分液漏斗中,振荡、静置,待液体分层后即可从上口倒出上层的乙酸乙酯(2)、乙装置优于甲装置的理由是。(至少说出两点)四、计算题
-
30. 分别取质量为ag的Fe2O3和CuO的混合固体粉末,进行如下实验:(1)、固体粉末在加热条件下用足量的CO还原,得到金属混合物bg,将生成的CO2气体用足量的澄清石灰水吸收后,产生cg白色沉淀。则a=g(用含b、c的代数式表示)。(2)、固体粉末溶于足量盐酸后,加入适量的铁粉,所得溶液中的金属离子只有Fe2+ , 同时收集到224mLH2(标准状况下),共用去0.03mol铁粉。则原混合物中Fe2O3的物质的量是(用含a的代数式表示)。
五、综合题
-
31. 在生产生活中氮及其化合物的应用和处理已引起广泛关注。(1)、合成氨的反应原理为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ/mol,如下图所示,将6molN2和14molH2充入一容积可变的密闭容器中发生反应,反应开始时活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示,下列表述能用来判断图2所示状态已达平衡的是 , 则该条件下反应的平衡常数为。
图1

图2

A.活塞不再移动
B.容器内气体压强不再改变
C.容器内气体密度不再改变
D.容器内气体的平均分子质量不再改变
(2)、研究者通过探索,发现利用反向燃料电池可以在温和的条件下将电解水制氢与氮、氢反应制氨合并(即将电解产生的活性氢作为中间产物直接还原氮气),其工作原理示意图如下:写出阴极电极方程式。 (3)、SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+ O2(g) 4N2(g)+6H2O(g),
(3)、SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+ O2(g) 4N2(g)+6H2O(g),①已知4NH3(g)+3O2(g) N2(g)+6H2O(g) ΔH1=-1269.0kJ/mol;
N2(g)+O2(g) 2NO(g) ΔH2=+180.8kJ/mol
则反应4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g)的ΔH=。
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应容器中反应10时测得NOx的去除率随反应温度的变化曲线如下图所示,请解释当反应温度高于380℃时NOx的去除率随温度升高先迅速下降后缓慢下降的原因。
③请在下图中画出反应8min时NOx的去除率随温度变化的曲线。

六、流程图
-
32. 某实验小组拟用碱性烂版液(主要成分为[Cu(NH3)4]Cl2和Cu(OH)2)为原料制取摩尔盐,并回收铜单质,设计流程如下:

已知温度超过60℃时,FeSO4在溶液中易形成FeSO4·H2O白色晶体,且一旦产生则难以消失。摩尔盐能溶于水,难溶于乙醇。
请回答下列问题:
(1)、写出[Cu(NH3)4]Cl2与稀硫酸反应的离子方程式。(2)、实验中第一步所用硫酸浓度为4mol/L,不能太小,原因是。(3)、关于该实验过程的下列说法中正确的是________。A、所加铁粉应该现用饱和碳酸钠溶液浸泡除去表面的油污,然后用倾析法分离,倾析法操作如图所示 B、溶液A与铁粉反应温度若高于60℃,会导致回收的铜不纯净
C、硫酸铵的用量,可以由溶解的铁粉的量决定,即溶解1mol铁粉,则所加硫酸铵也约为1mol
D、溶液B的pH控制在5-6之间,若pH过高,可用硫酸调节,以抑制Fe2+水解。
(4)、为从溶液C得到较纯的摩尔盐,请选择下列合适的操作并排序。
B、溶液A与铁粉反应温度若高于60℃,会导致回收的铜不纯净
C、硫酸铵的用量,可以由溶解的铁粉的量决定,即溶解1mol铁粉,则所加硫酸铵也约为1mol
D、溶液B的pH控制在5-6之间,若pH过高,可用硫酸调节,以抑制Fe2+水解。
(4)、为从溶液C得到较纯的摩尔盐,请选择下列合适的操作并排序。①用少量冰水洗涤 ②蒸发至较多晶体出现 ③溶液中加入无水乙醇 ④抽滤⑤冷却结晶 ⑥干燥
(5)、如何检验摩尔盐已经洗涤干净。(6)、为了测定产品中摩尔盐(M=392g/mol)的含量,某同学用分析天平称取5.220g的产品置于锥形瓶中,加适量去氧水溶解后用0.085mol/L的酸性KMnO4溶液滴定,滴定时读数如图,测得产品纯度为。
-
-
-