上海市静安区2018-2019学年高考化学一模考试试卷
试卷更新日期:2019-03-21 类型:高考模拟
一、单选题
-
1. 铯
 可用于超高精度原子钟,下列对于 和 描述错误的是() A、互为同位素 B、化学性质相同 C、质量数不同 D、核外电子数不同2. 氯化氢气体溶于水的过程中,破坏了()A、离子键 B、范德华力 C、共价键 D、金属键3. 工业上大量获得乙烯的方法是()A、石油裂解 B、乙醇脱水 C、石油分馏 D、煤干馏4. 在水溶液中,能完全电离的是()A、
可用于超高精度原子钟,下列对于 和 描述错误的是() A、互为同位素 B、化学性质相同 C、质量数不同 D、核外电子数不同2. 氯化氢气体溶于水的过程中,破坏了()A、离子键 B、范德华力 C、共价键 D、金属键3. 工业上大量获得乙烯的方法是()A、石油裂解 B、乙醇脱水 C、石油分馏 D、煤干馏4. 在水溶液中,能完全电离的是()A、 B、
B、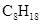 C、
C、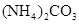 D、HClO
5. 金属铝不能用来()A、存储酸性溶液 B、冶炼难熔金属 C、制电线电缆 D、制航天材料6. 关于
D、HClO
5. 金属铝不能用来()A、存储酸性溶液 B、冶炼难熔金属 C、制电线电缆 D、制航天材料6. 关于 的说法,正确的是() A、含有两种官能团 B、与乙醇互为同系物 C、可看做乙烷的含氧衍生物 D、属于饱和烃7.
的说法,正确的是() A、含有两种官能团 B、与乙醇互为同系物 C、可看做乙烷的含氧衍生物 D、属于饱和烃7.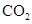 和
和  都是常见的非金属氧化物,二者共有的性质是() A、对应水化物为强酸 B、具有氧化性 C、通入
都是常见的非金属氧化物,二者共有的性质是() A、对应水化物为强酸 B、具有氧化性 C、通入 溶液产生白色沉淀
D、能使品红溶液褪色
8. 不能用元素周期律解释的是()A、酸性
溶液产生白色沉淀
D、能使品红溶液褪色
8. 不能用元素周期律解释的是()A、酸性 B、原子半径
B、原子半径  C、最高正价
C、最高正价  D、酸性
D、酸性  9. 下列反应能用
9. 下列反应能用 来表示的是() A、澄清石灰水与
来表示的是() A、澄清石灰水与 溶液反应
B、
溶液反应
B、 和
和 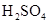 溶液反应
C、NaOH溶液和
溶液反应
C、NaOH溶液和  溶液反应
D、
溶液反应
D、 溶液和HI溶液反应
10. 加入或通入下列物质,无法使溴水褪色的是()A、
溶液和HI溶液反应
10. 加入或通入下列物质,无法使溴水褪色的是()A、 B、KI固体
C、NaOH固体
D、苯
11. 向新制饱和氯水中通入足量
B、KI固体
C、NaOH固体
D、苯
11. 向新制饱和氯水中通入足量 气体,不能使溶液() A、漂白性增强 B、导电性增强 C、酸性增强 D、褪色12. 有关饱和链烃的叙述,错误的是()A、都是可燃物 B、特征反应是取代反应 C、随碳原子个数增加,沸点依次升高 D、随氢原子个数增加,含氢量升高13. 一定量 固体加水溶解后,以石墨为电极电解该溶液。上述变化过程中会放出热量的是()A、
气体,不能使溶液() A、漂白性增强 B、导电性增强 C、酸性增强 D、褪色12. 有关饱和链烃的叙述,错误的是()A、都是可燃物 B、特征反应是取代反应 C、随碳原子个数增加,沸点依次升高 D、随氢原子个数增加,含氢量升高13. 一定量 固体加水溶解后,以石墨为电极电解该溶液。上述变化过程中会放出热量的是()A、 向水中扩散
B、
向水中扩散
B、 形成水合离子
C、
形成水合离子
C、 发生水解
D、电解产生Cu和
发生水解
D、电解产生Cu和  14. 反应 达到平衡后,升高温度,则()A、
14. 反应 达到平衡后,升高温度,则()A、 增大、
增大、  减小
B、平衡常数增大
C、
减小
B、平衡常数增大
C、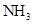 的含量增大
D、
的含量增大
D、 持续增大至不变
15. 对 溶液进行下列操作,观察到的现象与 水解有关的是()A、滴加NaOH溶液有沉淀产生 B、加热蒸干灼烧得到红棕色固体 C、通入
持续增大至不变
15. 对 溶液进行下列操作,观察到的现象与 水解有关的是()A、滴加NaOH溶液有沉淀产生 B、加热蒸干灼烧得到红棕色固体 C、通入 气体有沉淀产生
D、滴加KSCN试液溶液变红
16. 测定胆矾晶体结晶水含量时,不会引起实验误差的操作是()A、称取一定量胆矾晶体,研磨后转入铁坩埚中进行加热 B、大火加热,使胆矾晶体迅速升温失去结晶水并变黑 C、停止加热后,硫酸铜固体放在空气中冷却再称量 D、恒重操作时,连续两次称量结果相差
气体有沉淀产生
D、滴加KSCN试液溶液变红
16. 测定胆矾晶体结晶水含量时,不会引起实验误差的操作是()A、称取一定量胆矾晶体,研磨后转入铁坩埚中进行加热 B、大火加热,使胆矾晶体迅速升温失去结晶水并变黑 C、停止加热后,硫酸铜固体放在空气中冷却再称量 D、恒重操作时,连续两次称量结果相差 即停止加热
17. 对下图所示的钢铁电化学保护方法,分析正确的是()
即停止加热
17. 对下图所示的钢铁电化学保护方法,分析正确的是() A、是牺牲阳极的阴极保护法 B、钢闸门失去电子 C、电子从负极流向阴极 D、电子从阴极经海水流向阳极18. 从混合物中分离出下列物质,方案选择不当的是()
A、是牺牲阳极的阴极保护法 B、钢闸门失去电子 C、电子从负极流向阴极 D、电子从阴极经海水流向阳极18. 从混合物中分离出下列物质,方案选择不当的是()混合物
分离出
方案
A
和NaCl固体
升华
B
乙醇和甘油混合溶液
乙醇
蒸馏
C
乙酸乙酯和乙酸溶液
乙酸乙酯
饱和NaOH溶液,分液
D
和 固体
NaOH溶液,过滤
A、A B、B C、C D、D19. 某有机物的球棍模型如图所示,下列判断错误的是() A、分子中含极性键和非极性键 B、与
A、分子中含极性键和非极性键 B、与 加成最多可得到3种产物
C、易被酸性
加成最多可得到3种产物
C、易被酸性  溶液氧化
D、该有机物聚合反应的产物为混合物
20. 某溶液可能含有 、 、 、 、 、 离子,分别取样, 测得溶液显弱碱性; 加入足量盐酸,有无色无味气体产生。为确定溶液组成,还需要检测的离子是()A、
溶液氧化
D、该有机物聚合反应的产物为混合物
20. 某溶液可能含有 、 、 、 、 、 离子,分别取样, 测得溶液显弱碱性; 加入足量盐酸,有无色无味气体产生。为确定溶液组成,还需要检测的离子是()A、 B、
B、 C、
C、 D、
D、
二、综合题
-
21. 汽车安全气囊中填充叠氮酸钠 和硝酸钾 。汽车发生猛烈撞击时, 会迅速分解产生 和Na,Na单质可与 继续反应。完成下列填空:(1)、原子最外层电子的电子排布式为 , 氮气的电子式为。(2)、请将 、 、 按照离子半径由大到小的顺序排列 填离子符号 。(3)、 的金属性强于Na,用一个事实说明。(4)、配平Na与 反应的化学方程式,并标出电子转移的方向与数目:
,若标准状况下生成 氮气,转移的电子数目为 。
(5)、请解释 晶体比 晶体熔点低的原因。22. 工业上生产尿素的过程中会生成氨基甲酸铵 。氨基甲酸铵加热时易分解,在潮湿空气中易水解。完成下列填空:一定温度下,n mol氨基甲酸铵在VL密闭真空容器中分解
实验测得不同温度下容器内的平衡总压强如下表:
温度
平衡总压强
(1)、根据上表判断,反应中Q 填写“ ”或“ ” ,判断依据是。(2)、能说明该反应达到平衡状态的是 填序号 。不再变化
b.
c.混合气体的平均分子质量不再变化
d.混合气体的密度不再变化
(3)、写出该反应平衡常数的表达式 。 时,反应t分钟后固体的物质的量减少一半,t分钟内用 表示的化学反应速率 。氨基甲酸铵在潮湿空气中可水解得到氨水和碳酸氢铵。 、 、 都是重要的氮肥。
(4)、25℃时,浓度均为 的氨水与NaOH溶液,下列说法错误的是。两溶液导电能力不同
b.两溶液 不同
c.两溶液中水的电离程度不同
d.两溶液中水的离子积不同
(5)、同温度、同浓度的 溶液和 溶液中, 较小的是溶液,其原因是。(6)、25℃时,向一定量 饱和溶液中加入与溶质 等物质的量的NaCl固体,充分反应后,根据图判断,此时溶液中离子浓度最大的是。
三、推断题
-
23. 从酯类化合物A出发,一定条件下可发生如下的物质相互转化。完成下列填空:
 (1)、化合物G的名称是 , C中含氧官能团的名称是。(2)、反应 的反应类型是 , 反应 所需试剂与条件是。(3)、书写反应 的化学方程式(4)、写出A的结构简式。(5)、写出一种C的苯环上只有一个侧链并可发生水解的同分异构体的结构简式。(6)、设计一条由
(1)、化合物G的名称是 , C中含氧官能团的名称是。(2)、反应 的反应类型是 , 反应 所需试剂与条件是。(3)、书写反应 的化学方程式(4)、写出A的结构简式。(5)、写出一种C的苯环上只有一个侧链并可发生水解的同分异构体的结构简式。(6)、设计一条由 为原料制备 的合成路线。 合成路线常用的表示方式为:
为原料制备 的合成路线。 合成路线常用的表示方式为:  目标产物
目标产物 四、实验题
-
24. 某化学兴趣小组设计了如图所示装置探究氨的还原性,A为氨气的制备装置。完成下列填空:
 (1)、中通过加热 固体来制备氨气,除铁架台 含铁夹 和酒精灯外还需用到的是 选填下列仪器编号 。
(1)、中通过加热 固体来制备氨气,除铁架台 含铁夹 和酒精灯外还需用到的是 选填下列仪器编号 。 (2)、补充完整后,有同学认为装置在安全性上还存在缺陷,需要在 填序号 连接图所示装置。
(2)、补充完整后,有同学认为装置在安全性上还存在缺陷,需要在 填序号 连接图所示装置。之间
b.B-C之间
c.C-D之间
d.D之后

按照改进后的装置进行实验,检验气密性后,先将C处的铂丝加热到红热,再将A处气体通过B装置片刻后,撤去C处酒精灯继续反应,可观察到的部分现象为:铂丝保持红热,D中溶液变红。
(3)、中所得混合气体通过B后会产生 ,B中反应的还原剂是。(4)、写出C中 与 反应的化学方程式 , 可用于判断该反应是放热还是吸热的实验现象是。(5)、使D中石蕊溶液变红的物质是 填写化学式 。(6)、有同学认为,D中溶液内可能含有 ,如何检验。
-