江苏省南通市2018-2019学年高考化学一模考试试卷
试卷更新日期:2019-03-21 类型:高考模拟
一、单选题
-
1. 2019年政府工作报告提出:继续坚定不移地打好包括污染防治在内的“三大攻坚战”。下列做法不符合这一要求的是()A、推广新能源汽车,减少氮氧化物排放 B、研发可降解塑料,控制白色污染产生 C、直接灌溉工业废水,充分利用水资源 D、施用有机肥料,改善土壤微生物环境2. 下列有关化学用语表示正确的是()A、氧化钠的电子式:
 B、中子数为18的氯原子:
B、中子数为18的氯原子:  C、氮离子(N3-)的结构示意图:
C、氮离子(N3-)的结构示意图:  D、聚丙烯的结构简式:
D、聚丙烯的结构简式:  3. 下列有关物质性质与用途具有对应关系的是()A、热纯碱溶液碱性强,可用于去除油污 B、氧化铁粉末呈红色,可用于制取铁盐 C、硅晶体有金属光泽,可用于制造芯片 D、氢氟酸具有弱酸性,可用于蚀刻玻璃4. 常温下,下列各组离子在指定溶液中能大量共存的是()A、0.1 mol·L-1FeSO4溶液:Na+、K+、Cl-、NO3- B、滴入酚酞变红色的溶液:K+、Ca2+、HCO3-、CO32- C、加入铁粉放出氢气的溶液:NH4+、Fe3+、ClO-、SO42- D、水电离的c(H+)=1×10-13mol·L-1的溶液:K+、Mg2+、I-、C6H5O-5. 下列实验室制取、干燥、收集NH3并进行尾气处理的装置和原理能达到实验目的的是()A、
3. 下列有关物质性质与用途具有对应关系的是()A、热纯碱溶液碱性强,可用于去除油污 B、氧化铁粉末呈红色,可用于制取铁盐 C、硅晶体有金属光泽,可用于制造芯片 D、氢氟酸具有弱酸性,可用于蚀刻玻璃4. 常温下,下列各组离子在指定溶液中能大量共存的是()A、0.1 mol·L-1FeSO4溶液:Na+、K+、Cl-、NO3- B、滴入酚酞变红色的溶液:K+、Ca2+、HCO3-、CO32- C、加入铁粉放出氢气的溶液:NH4+、Fe3+、ClO-、SO42- D、水电离的c(H+)=1×10-13mol·L-1的溶液:K+、Mg2+、I-、C6H5O-5. 下列实验室制取、干燥、收集NH3并进行尾气处理的装置和原理能达到实验目的的是()A、 制取NH3
B、
制取NH3
B、 干燥NH3
C、
干燥NH3
C、 收集NH3
D、
收集NH3
D、 处理尾气
6. 下列有关物质性质的叙述正确的是()A、二氧化硫能使紫色石蕊溶液褪色 B、氯水久置后,漂白性和酸性均增强 C、常温下,铁片不能与浓硝酸发生反应 D、植物油能使溴的四氯化碳溶液褪色7. 下列指定反应的离子方程式正确的是()A、向氨水中通入过量SO2:NH3·H2O+SO2=NH4++HSO3- B、Si与NaOH溶液反应:Si+2OH-+H2O=SiO32-+H2↑ C、电解MgCl2溶液:
处理尾气
6. 下列有关物质性质的叙述正确的是()A、二氧化硫能使紫色石蕊溶液褪色 B、氯水久置后,漂白性和酸性均增强 C、常温下,铁片不能与浓硝酸发生反应 D、植物油能使溴的四氯化碳溶液褪色7. 下列指定反应的离子方程式正确的是()A、向氨水中通入过量SO2:NH3·H2O+SO2=NH4++HSO3- B、Si与NaOH溶液反应:Si+2OH-+H2O=SiO32-+H2↑ C、电解MgCl2溶液: D、Ba(OH)2溶液中滴入NaHSO4溶液至Ba2+恰好完全沉淀:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
8. 短周期主族元素X、Y、Z、W原子序数依次增大,X、Y处于同一周期,X原子最外层电子数是次外层电子数的3倍,Z是地壳中含量最多的金属元素,W的最高正价与最低负价绝对值相等。下列说法正确的是()A、原子半径:r(X)>r(Y)>r(Z) B、由Y、W形成的化合物是共价化合物 C、Z的最高价氧化物对应的水化物是一种强碱 D、Y的简单气态氢化物的热稳定性比W的弱9. 在给定条件下,下列选项所示的物质间转化均能实现的是()A、NaCl(熔融)
D、Ba(OH)2溶液中滴入NaHSO4溶液至Ba2+恰好完全沉淀:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
8. 短周期主族元素X、Y、Z、W原子序数依次增大,X、Y处于同一周期,X原子最外层电子数是次外层电子数的3倍,Z是地壳中含量最多的金属元素,W的最高正价与最低负价绝对值相等。下列说法正确的是()A、原子半径:r(X)>r(Y)>r(Z) B、由Y、W形成的化合物是共价化合物 C、Z的最高价氧化物对应的水化物是一种强碱 D、Y的简单气态氢化物的热稳定性比W的弱9. 在给定条件下,下列选项所示的物质间转化均能实现的是()A、NaCl(熔融)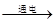 NaOH
NaOH  NaAlO2
B、CuO
NaAlO2
B、CuO  Cu(OH)2
Cu(OH)2  Cu2O
C、Cl2
Cu2O
C、Cl2  HCl
HCl  NH4Cl
D、CaCl2(aq)
NH4Cl
D、CaCl2(aq)  CaCO3
CaCO3  CaSiO3
10. 下列说法正确的是()A、合成氨生产中,使用高效催化剂可提高原料平衡转化率 B、铁质管道与锌用导线相连(如图所示)可防止管道被腐蚀
CaSiO3
10. 下列说法正确的是()A、合成氨生产中,使用高效催化剂可提高原料平衡转化率 B、铁质管道与锌用导线相连(如图所示)可防止管道被腐蚀 C、5mL18 mol·L-1浓硫酸与足量铜共热,反应最多转移0.18mol电子
D、常温下,反应2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,该反应ΔH>0
11. 化合物Z是合成平喘药沙丁胺醇的中间体,可通过下列路线制得:
C、5mL18 mol·L-1浓硫酸与足量铜共热,反应最多转移0.18mol电子
D、常温下,反应2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,该反应ΔH>0
11. 化合物Z是合成平喘药沙丁胺醇的中间体,可通过下列路线制得:
下列说法正确的是()
A、X分子中所有原子在同一平面上 B、Y与足量H2的加成产物分子中有2个手性碳原子 C、可用FeCl3溶液鉴别Y和Z D、1molZ最多能与2molNaOH反应12. 根据下列图示所得出的结论正确的是()甲
 乙
乙  丙
丙 
丁
 A、图甲表示1mLpH=2某一元酸溶液加水稀释时,pH随溶液总体积的变化曲线,说明该酸是强酸 B、图乙表示恒容密闭容器中其他条件相同时改变温度,反应CO2(g)+3H2(g)
A、图甲表示1mLpH=2某一元酸溶液加水稀释时,pH随溶液总体积的变化曲线,说明该酸是强酸 B、图乙表示恒容密闭容器中其他条件相同时改变温度,反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)中n(CH3OH)随时间的变化曲线,说明反应平衡常数KⅠ>KⅡ
C、图丙表示不同温度下水溶液中-lgc(H+)、-lgc(OH-)变化曲线,说明T1>T2
D、图丁表示1molH2和0.5molO2反应生成1molH2O过程中的能量变化曲线,说明H2的燃烧热是241.8kJ·mol-1
CH3OH(g)+H2O(g)中n(CH3OH)随时间的变化曲线,说明反应平衡常数KⅠ>KⅡ
C、图丙表示不同温度下水溶液中-lgc(H+)、-lgc(OH-)变化曲线,说明T1>T2
D、图丁表示1molH2和0.5molO2反应生成1molH2O过程中的能量变化曲线,说明H2的燃烧热是241.8kJ·mol-1
二、多选题
-
13. 下列设计的实验方案能达到实验目的的是()A、检验亚硫酸钠溶液是否变质:取少量溶液,向其中加入硝酸酸化的硝酸钡溶液 B、制取乙酸乙酯:向试管中加入碎瓷片,再依次加入3mL乙醇、2mL浓硫酸和2mL乙酸,用酒精灯加热,将产生的蒸气经导管通到饱和氢氧化钠溶液的上方 C、除去溴化钠溶液中混有的碘化钠:向溶液中加入稍过量溴水,充分反应后,加入四氯化碳,振荡后静置、分液,取上层溶液 D、探究温度对反应速率的影响:将2支均装有5mL0.1mol·L-1硫代硫酸钠溶液的试管分别置于冰水和热水中,再同时向试管中加入5mL0.1mol·L-1稀硫酸14. 室温下,下列指定溶液中微粒的物质的量浓度关系一定正确的是()A、20mL0.1mol·L-1CH3COONa溶液中加入0.1mol·L-1盐酸至溶液pH=7:c(CH3COOH)=c(Cl-) B、向澄清石灰水中通入Cl2至Ca(OH)2恰好完全反应:c(Ca2+)+c(H+)=c(OH-)+c(Cl-)+c(ClO-) C、0.2mol·L-1CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合(pH<7):c(H+)+c(CH3COOH)>c(OH-)+c(CH3COO-) D、0.1mol·L-1CH3COOH溶液与0.1 mol·L-1Na2CO3溶液等体积混合(无气体逸出):c(CO32-)<c(CH3COOH)+c(H2CO3)15. 在三个容积均为2L的密闭容器中按不同方式投入反应物,发生反应:
CO(g)+H2O(g)
 CO2(g)+H2(g)ΔH=-akJ·mol-1(a>0)
CO2(g)+H2(g)ΔH=-akJ·mol-1(a>0)相关反应数据如下:
容器
容器类型
起始温度/

起始物质的量/mol
平衡时H2物质的量/mol
CO
H2O
CO2
H2
Ⅰ
恒温恒容
800
1.2
0.6
0
0
0.4
Ⅱ
恒温恒容
900
0.7
0.1
0.5
0.5
Ⅲ
绝热恒容
800
0
0
1.2
0.8
下列说法正确的是()
A、容器Ⅰ中反应经10min建立平衡,0~10min内,平均反应速率v(CO)=0.04mol·L-1·min-1 B、若向容器Ⅰ平衡体系中再加入CO、H2O、CO2、H2各0.1mol,平衡将正向移动 C、达到平衡时,容器Ⅱ中反应吸收的热量小于0.1akJ D、达平衡时,容器Ⅲ中n(CO)<0.48mol三、工业流程
-
16. 以粉煤灰(主要成分为Al2O3、SiO2 , 还含少量Fe2O3等)为原料制取氧化铝的部分工艺流程如下:
 (1)、“酸浸”过程发生的主要反应的离子方程式是。
(1)、“酸浸”过程发生的主要反应的离子方程式是。“酸浸”在恒容密闭反应釜中进行,温度不宜过高的原因是。
(2)、“除铁”生成Fe(OH)3的离子方程式为 , 检验溶液中铁元素已经除尽的方法是。(3)、“结晶”是向浓溶液中通入HCl气体,从而获得AlCl3·6H2O晶体的过程,溶液中Al3+和盐酸的浓度随通气时间的变化如下图所示。Al3+浓度减小的原因是。 (4)、上述流程中,可以循环利用的物质是。17. 磷酸二氢钾(KH2PO4)是一种高效复合肥。工业上以羟磷灰石精矿[主要成分是Ca5(PO4)3OH,还含有少量石英和氧化铁等杂质]为原料,生产磷酸二氢钾的流程如下:
(4)、上述流程中,可以循环利用的物质是。17. 磷酸二氢钾(KH2PO4)是一种高效复合肥。工业上以羟磷灰石精矿[主要成分是Ca5(PO4)3OH,还含有少量石英和氧化铁等杂质]为原料,生产磷酸二氢钾的流程如下: (1)、“制酸”过程中生成磷酸的化学方程式为。
(1)、“制酸”过程中生成磷酸的化学方程式为。该过程若用硫酸代替盐酸,磷酸的产率明显降低,其原因是。
(2)、“反应”中加入有机碱——三辛胺(TOA)的目的是。 (3)、“反应”中,三辛胺的用量会影响溶液的pH。水溶液中H3PO4、H2PO4-、HPO42-、PO43-的分布分数δ随pH的变化如右图所示。
(3)、“反应”中,三辛胺的用量会影响溶液的pH。水溶液中H3PO4、H2PO4-、HPO42-、PO43-的分布分数δ随pH的变化如右图所示。①“反应”中,当pH=时,停止加入三辛胺。
②使用pH试纸测定溶液pH的操作是。
(4)、查阅资料可知:①磷酸三丁酯、二(2乙基己基)磷酸都是难溶于水的液态有机物。②磷酸三丁酯对H3PO4和Fe3+有较强的萃取作用。
③二(2乙基己基)磷酸仅对Fe3+有较强的萃取作用。
请根据题中信息,补充完整“提纯”步骤的实验方案:向“制酸”所得粗磷酸中加入活性炭, , 向有机层中加入蒸馏水,振荡、静置,分液取水层,得到稀磷酸。[实验中须使用的试剂有:二(2乙基己基)磷酸、磷酸三丁酯]
四、推断题
-
18. 苯达莫司汀(Bendamustine)是一种抗癌药物。苯达莫司汀的一种合成路线如下:

 (1)、D中含氧官能团有酰胺键、(填名称)。(2)、A→B的反应类型为。(3)、E的分子式为C12H13N3O4 , 写出E的结构简式:。(4)、G是
(1)、D中含氧官能团有酰胺键、(填名称)。(2)、A→B的反应类型为。(3)、E的分子式为C12H13N3O4 , 写出E的结构简式:。(4)、G是 的同分异构体,G能发生银镜反应,分子中只有2种不同化学环境的氢。写出一种符合条件的G的结构简式:。
(5)、已知:
的同分异构体,G能发生银镜反应,分子中只有2种不同化学环境的氢。写出一种符合条件的G的结构简式:。
(5)、已知: 。请写出以
。请写出以  乙醇为原料制备
乙醇为原料制备  的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
五、综合题
-
19. 草酸合铜酸钾是一种重要的化工原料,其晶体组成可表示为KxCuy(C2O4)z·wH2O。(1)、实验室用CuSO4溶液和NaOH溶液混合制备Cu(OH)2 , 再将所得Cu(OH)2与KHC2O4溶液混合,可制备草酸合铜酸钾晶体。
①已知室温下,Ksp[Cu(OH)2]=2.2×10-20。制备Cu(OH)2的过程中,pH=7时,溶液中c(Cu2+)=。
②已知H2C2O4是二元弱酸。室温下,Ka1(H2C2O4)=5.4×10-2 , Ka2(H2C2O4)=5.4×10-5 , KHC2O4水解平衡常数的数值为。
(2)、一种测定草酸合铜酸钾晶体组成的方法如下:步骤Ⅰ准确称取1.7700g样品,充分加热,剩余固体为K2CO3与CuO的混合物,质量为1.0900g。
步骤Ⅱ准确称取1.770 0 g样品,用NH4Cl溶液溶解、加水稀释,定容至100mL。
步骤Ⅲ准确量取步骤Ⅱ所得溶液25.00 mL于锥形瓶中,滴入指示剂,用浓度为0.05000mol·L-1的EDTA标准溶液滴定至终点。(已知Cu2+与EDTA反应的化学计量数之比为1∶1)。
重复上述滴定操作两次,有关数据记录如下表:
第一次滴定
第二次滴定
第三次滴定
消耗EDTA标准溶液
的体积/mL
25.92
24.99
25.01
①第一次滴定消耗的EDTA标准溶液的体积明显偏大,可能的原因有(填字母)。
A.锥形瓶水洗后未干燥
B.滴定时锥形瓶中有液体溅出
C.装EDTA标准溶液的滴定管水洗后未润洗
D.开始滴定时,滴定管尖嘴部分未充满液体
②通过计算确定该样品的化学式(写出计算过程)。
20. 消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。(1)、已知:N2(g)+O2(g)=2NO(g) ΔH=akJ·mol-12NO(g)+O2(g)=2NO2(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=c kJ·mol-1
反应8NH3(g)+6NO2(g)=7N2(g)+12H2O(l) ΔH=kJ·mol-1。
(2)、水体中过量氨氮(以NH3表示)会导致水体富营养化。①用次氯酸钠除去氨氮的原理如图1所示。写出该图示的总反应化学方程式:。该反应需控制温度,温度过高时氨氮去除率降低的原因是。
 图1
图1  图2
图2图3

②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaClO)∶m(NH3)的变化情况如图2所示。点B剩余NaClO含量低于点A的原因是。当m(NaClO)∶m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是。
(3)、电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用电解产生的活性原子将NO3-还原为N2 , 工作原理如图3所示。①写出该活性原子与NO3-反应的离子方程式:。
②若阳极生成标准状况下2.24 L气体,理论上可除去NO3-的物质的量为mol。
21. 室温下,[Cu(NH3)4](NO3)2与液氨混合并加入Cu可制得一种黑绿色晶体。(1)、基态Cu2+核外电子排布式是。(2)、黑绿色晶体的晶胞如图所示,写出该晶体的化学式:。 (3)、不考虑空间构型,[Cu(NH3)4]2+的结构可用示意图表示为(用“→”标出其中的配位键)。(4)、NO3-中N原子轨道的杂化类型是。与NO3-互为等电子体的一种分子为(填化学式)。(5)、液氨可作制冷剂,气化时吸收大量热量的原因是。
(3)、不考虑空间构型,[Cu(NH3)4]2+的结构可用示意图表示为(用“→”标出其中的配位键)。(4)、NO3-中N原子轨道的杂化类型是。与NO3-互为等电子体的一种分子为(填化学式)。(5)、液氨可作制冷剂,气化时吸收大量热量的原因是。六、实验题
-
22. 肉桂酸为微有桂皮香气的无色针状晶体,能抑制黑色酪氨酸酶的形成,是高级防晒霜中不可少的成分之一。实验室制取肉桂酸的原理如下:

实验步骤:
步骤1在图1所示装置(夹持与加热仪器未画出,下同)的三颈烧瓶内加入K2CO3、苯甲醛(油状物)和乙酸酐,混合均匀后,在170 ℃~180 ℃加热反应1 h,冷却。
 图1
图1  图2
图2  图3
图3步骤2向三颈烧瓶内分批加入20 mL水和Na2CO3固体,调节溶液pH约为8。
步骤3在三颈烧瓶中加入活性炭,用图2所示水蒸气蒸馏装置蒸馏除去未反应的苯甲醛。
步骤4将三颈烧瓶内反应混合物趁热过滤,滤液冷却至室温,用浓盐酸酸化至pH=3,析出大量晶体,抽滤。并用少量冷水洗涤晶体。
步骤5将晶体在图3所示热水浴上加热干燥。
(1)、图1中仪器A的作用是。(2)、步骤2中Na2CO3需分批加入的原因是。(3)、水蒸气蒸馏时,判断蒸馏结束的方法是。(4)、步骤4中,“趁热过滤”的目的是。(5)、抽滤时所需主要仪器有、安全瓶及抽气泵等。(6)、与使用烘箱烘干相比,热水浴干燥的优点是。
-