辽宁省沈阳市铁西区2018-2019学年九年级上学期化学期末考试试卷
试卷更新日期:2019-03-19 类型:期末考试
一、单选题
-
1. 下列自然现象中,属于化学变化的是( )A、冰川融化 B、水的汽化 C、森林起火 D、汽油挥发2. 下列图示实验操作中,错误的是:( )A、
 B、
B、 C、
C、 D、
D、 3. 下列过程中利用了氧气物理性质的是( )A、推进火箭的过程中使用液态氧 B、炼钢的过程中使用纯氧 C、用排水集气法收集氧气 D、急救病人时输氧气4. 下列有关水的说法错误的是( )A、蒸馏水是软水 B、通过过滤和活性炭吸附处理后,硬水可以得到软化 C、硬水属于混合物 D、锅炉中使用硬水容易产生水垢,甚至引起锅炉爆炸5. 紫薯富含淀粉、蛋白质、维生素、钾、铁、钙、硒等,具有特殊的保健功能。其中的押、铁、钙、硒指的是( )A、单质 B、原子 C、分子 D、元素6. 核电荷数少于核外电子数的一定是( )A、分子 B、原子 C、阳离子 D、阴离子7. 某同学制作的试剂标签如下,其中化学式书写错误的是( )A、
3. 下列过程中利用了氧气物理性质的是( )A、推进火箭的过程中使用液态氧 B、炼钢的过程中使用纯氧 C、用排水集气法收集氧气 D、急救病人时输氧气4. 下列有关水的说法错误的是( )A、蒸馏水是软水 B、通过过滤和活性炭吸附处理后,硬水可以得到软化 C、硬水属于混合物 D、锅炉中使用硬水容易产生水垢,甚至引起锅炉爆炸5. 紫薯富含淀粉、蛋白质、维生素、钾、铁、钙、硒等,具有特殊的保健功能。其中的押、铁、钙、硒指的是( )A、单质 B、原子 C、分子 D、元素6. 核电荷数少于核外电子数的一定是( )A、分子 B、原子 C、阳离子 D、阴离子7. 某同学制作的试剂标签如下,其中化学式书写错误的是( )A、 B、
B、 C、
C、 D、
D、 8. 小明设计了如图装置探究“微粒是不断运动的”,一段时间后,可观察到的无色酚酞试液变红,则物质A是( )
8. 小明设计了如图装置探究“微粒是不断运动的”,一段时间后,可观察到的无色酚酞试液变红,则物质A是( ) A、浓氨水 B、浓盐酸 C、石灰水 D、双氧水9. 小聪为了探究燃烧的条件,设计了如图实验装置.通过用力上下振荡锥形瓶可以看到白磷燃烧水火相容的场景,停止振荡则火焰熄灭.该实验直接说明的燃烧需要的条件是( )
A、浓氨水 B、浓盐酸 C、石灰水 D、双氧水9. 小聪为了探究燃烧的条件,设计了如图实验装置.通过用力上下振荡锥形瓶可以看到白磷燃烧水火相容的场景,停止振荡则火焰熄灭.该实验直接说明的燃烧需要的条件是( )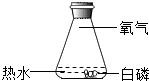 A、必须用力上下振荡 B、要有可燃物 C、温度达到可燃物的着火点 D、与氧气(或空气)接触10. 下列有关铁的说法中错误的是( )A、生铁中碳的质量分数低于20% B、铁质地较软,能传热导电 C、在铁制品表面镀锌能防止铁被锈蚀 D、冶炼铁的主要原料是铁矿石、焦炭、石灰石、热空气11. 研发高性能“中国芯”是我国信息产业的当务之急。“中国芯”的主要材料是高纯度的单质硅,工业上用SiO2+2C Si+2CO↑来制取粗硅,下列说法正确的是( )A、生成CO的原因是O2不足 B、该反应为置换反应 C、硅元素在地壳中的含量比氧元素多 D、该反应体现了C的氧化性12. 民间常用川乌、草乌泡制药酒。川乌、草乌含有少量有毒物质乌头碱(化学式为C34H47NO11),药酒使用不当会造成中毒。下列关于乌头碱的说法错误的是( )A、乌头碱由四种元素组成 B、乌头碱分子中C,H原子个数比为34:47 C、乌头碱在空气中充分燃烧只生成CO2和H2O D、每个乌头碱分子由93个原子构成13. 下列实验操作不能达到实验目的是( )
A、必须用力上下振荡 B、要有可燃物 C、温度达到可燃物的着火点 D、与氧气(或空气)接触10. 下列有关铁的说法中错误的是( )A、生铁中碳的质量分数低于20% B、铁质地较软,能传热导电 C、在铁制品表面镀锌能防止铁被锈蚀 D、冶炼铁的主要原料是铁矿石、焦炭、石灰石、热空气11. 研发高性能“中国芯”是我国信息产业的当务之急。“中国芯”的主要材料是高纯度的单质硅,工业上用SiO2+2C Si+2CO↑来制取粗硅,下列说法正确的是( )A、生成CO的原因是O2不足 B、该反应为置换反应 C、硅元素在地壳中的含量比氧元素多 D、该反应体现了C的氧化性12. 民间常用川乌、草乌泡制药酒。川乌、草乌含有少量有毒物质乌头碱(化学式为C34H47NO11),药酒使用不当会造成中毒。下列关于乌头碱的说法错误的是( )A、乌头碱由四种元素组成 B、乌头碱分子中C,H原子个数比为34:47 C、乌头碱在空气中充分燃烧只生成CO2和H2O D、每个乌头碱分子由93个原子构成13. 下列实验操作不能达到实验目的是( )选项
实验目的
实验操作
A
鉴别NH4HCO3和Cu(OH)2
观察颜色
B
除去CO2中少量的CO
点燃
C
鉴别H2O和H2O2溶液
分别取少量液体于试管中,加入MnO2
D
除去Cu粉中少量的Fe粉
用磁铁吸引
A、A B、B C、C D、D二、填空题
-
14. 空气是自然界赋予人类的重要资源。研究空气的成分,正确认识空气,合理利用空气是化学的任务之一。
 (1)、某同学利用燃磷法测定空气中氧气含量,实验过程如图所示。
(1)、某同学利用燃磷法测定空气中氧气含量,实验过程如图所示。①该实验测得氧气的体积分数约是%.与实际值进行对比,说明存在误差的可能原因是。
②燃烧结束时,试管里剩余气体的主要性质是。
15. 化学是在分子、原子水平上研究物质的科学。(1)、构成物质的微粒有分子、原子和。(2)、如图为三种元素的原子结构示意图。
①氧原子在化学反应中容易电子(填“得到”或“失去”)。
②硒元素能增强人体免疫力,延缓衰老,山药等食物中常含硒元素。硒(Se)在氧气中燃烧生成二氧化硒。回答下列问题:
A.硒原子的核电荷数为;
B.硒元素与氧元素、硫元素的化学性质相似,原因是它们的原子相同;
C.写出硒在氧气中燃烧的化学方程式。
16. 2017年9月新闻报道,我国成功提纯了“超级金属”铼。铼及其合金被广泛应用到航空航天领域。金属铼硬度大,熔点很高,在高温下能与硫化合形成二硫化铼。 (1)、铼的相对原子质量是。(2)、上述信息中,属于金属铼的物理性质的是。(3)、七氧化二铼(Re2O7)是铼最常见的氧化物,其中铼元素的化合价为。17. 下图是实验室中常用的几种装置,回答下列问题:
(1)、铼的相对原子质量是。(2)、上述信息中,属于金属铼的物理性质的是。(3)、七氧化二铼(Re2O7)是铼最常见的氧化物,其中铼元素的化合价为。17. 下图是实验室中常用的几种装置,回答下列问题: (1)、写出有编号仪器的名称:① , ②。(2)、利用上述B、C装置的组合可以制取的一种气体是;写出制取该气体的化学方程式。为防止生成的气体从长颈漏斗逸出,添加的液体直至。(3)、如果某同学要用氯酸钾和二氧化锰制取较纯净的氧气,选择的最佳装置是。(4)、待氯酸钾完全分解后,若想在反应后的固体中提取出氯化钾,可经过以下三个操作: 溶解 →→ , 便可得到少量的氯化钾固体。
(1)、写出有编号仪器的名称:① , ②。(2)、利用上述B、C装置的组合可以制取的一种气体是;写出制取该气体的化学方程式。为防止生成的气体从长颈漏斗逸出,添加的液体直至。(3)、如果某同学要用氯酸钾和二氧化锰制取较纯净的氧气,选择的最佳装置是。(4)、待氯酸钾完全分解后,若想在反应后的固体中提取出氯化钾,可经过以下三个操作: 溶解 →→ , 便可得到少量的氯化钾固体。三、推断题
-
18. A~G 是初中化学常见的物质,它们之间的转化关系如图所示。其中 A、B、C、D 都是氧化物,E、F、G 都是金属单质,且 F 为导电性、导热性最好的金属,A 和 G 均为红色固体(其中部分反应条件、反应物及生成物已略去)。请回答下列问题:
 (1)、写出 G 物质的化学式。(2)、写出 B 物质的一种用途。(3)、写出①反应的化学方程式。 写出②反应的化学方程式。(4)、从微观角度解释 B 和 D 两种物质性质不同的原因。
(1)、写出 G 物质的化学式。(2)、写出 B 物质的一种用途。(3)、写出①反应的化学方程式。 写出②反应的化学方程式。(4)、从微观角度解释 B 和 D 两种物质性质不同的原因。四、流程题
-
19. 利用空气制取氮肥的主要流程如下:
 (1)、
(1)、①过程I是利用空气中各成分的不同,分离得到N2。
②过程Ⅱ中,N2和H2反应生成NH3 , 该反应为(填“化合”或“分解”)反应。
③过程Ⅲ中发生反应的化学方程式为4NH3+5O2 4NO+6H2O,若参加反应的NH3为68kg,理论上生成NO的质量为kg。
④过程Ⅳ发生反应的微观示意图如图:

过程Ⅳ发生反应的化学方程式为 , 反应中各物质的质量比为。
(2)、酒店提供的“液氮冰淇淋”是用液氮使奶油等原料快速冻结而制成的无冰渣感的冰淇淋。利用液氮制作冰淇淋,是因为液氮。五、简答题
-
20. 化学反应都遵守质量守恒定律,请根据质量守恒定律的相关知识回答下列问题:(1)、下列各项中,在化学反应前后一定不变的是(填数字序号)。
①元素的种类 ②物质的种类 ③原子的种类
④分子的种类 ⑤原子的数目⑥分子的数目
(2)、应用质量守恒定律配平化学方程式:FeS2+O2 SO2+Fe2O3
(3)、实验室常用如图所示实验验证质量守恒定律。四位同学设计了如下A、B、C、D四个实验,并在实验前后分别测定装置的总质量。
①实验中观察到B、C实验前后天平依然保持平衡,某同学认为B、C实验都能验证质量守恒定律,请你帮助分析他的结论是否正确并说明理由。。
②C中的现象是。而A、D实验天平不平衡,其中D实验天平不平衡的原因是 , A实验的化学方程式为。
六、科学探究题
-
21. 铁是世界上年产量最高的金属,铁及其合金也是应用最广泛的金属材料。请根据我们所学的有关金属的知识回答问题:
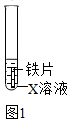 (1)、验证金属的活动性(实验装置如图1)
(1)、验证金属的活动性(实验装置如图1)①若要证明Fe在金属活动性顺序中位于氢前,X溶液可选用 , 其现象为。
②若X溶液为少量硫酸铜溶液,该反应的化学方程式为。待充分反应后,取出铁片,放入金属R,观察到R表面有黑色固体析出。根据上述实验现象,得出Fe、Cu、R的金属活动性顺序为。
(2)、某纯净气体通过如图2装置时,可观察到:A中紫色石蕊试液不变色,C中澄清石灰水变浑浊。请按要求回答问题:
①纯净气体可以是CO.若黑色固体为 , 反应过程中B处可以观察到黑色固体的明显实验现象。
②纯净气体可以是CO.但B处无明显实验现象,则B处发生反应的化学方程式为。
③纯净气体和黑色固体的组合还可以是 , 则B处的实验现象为。
(3)、铝是地壳中含量最高的金属元素。某小组同学在实验室研究铝与氯化铜溶液的反应液的反应。实验操作
实验现象

A.红色物质附着于铝片表面
B.铝片表面逸出大量无色气体,放出大量的热
C.烧杯底部出现红色沉淀和白色沉淀
①现象A和现象C中的红色物质均为Cu,生成该物质的化学方程式为。
②经检验,现象B中的无色气体为氢气。甲同学猜测可能是氯化铜溶液显酸性。经实验检测,证实了甲的猜想。
③探究白色沉淀的化学成分。
(4)、(推理猜想)乙同学通过查阅资料认为白色沉淀可能是氯化亚铜(CuCl)。
(查阅资料)
★CuCl可与浓氨水反应生成无色的Cu(NH3)2+和Cl-
★Cu(NH3)2+在空气中易被氧化变为蓝色:Cl-可与硝酸银溶液反应,产生白色沉淀。
(进行实验)
步骤一:取烧杯底部的白色沉淀,充分洗涤;
步骤二:向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
步骤三:取其中一份无色溶液……
步骤四:将另一份无色溶液放置于空气中……
以上步骤三的实验方案是;
步骤四的现象是。
(得出结论)通过实验可以确定,该白色固体是CuCl。
(5)、(反思与评价)A和CuCl2溶液反应为什么会出现CuCl呢?丙同学猜测:可能是Cu与CuCl2溶液反应生成了CuCl。
丙同学为了验证猜想,取Cu粉与15%CuCl2溶液混合,无白色沉淀产生。
④丙通过分析Al与CuCl2溶液反应的实验现象,改进了实验,证明了Cu与CuCl2溶液反应生成了CuCl,改进之处是。
⑤丁同学认为丙同学的实验还不够严谨,还应考虑对Cu与CuCl2溶液反应的影响。
-
-
-