江苏省如皋市2018-2019学年九年级上学期化学期末考试试卷
试卷更新日期:2019-03-19 类型:期末考试
一、单选题
-
1. “微笑之城,圆梦之地”——文明城市如皋新名片。下列做法与此不相符的是( )A、工业废气净化排放 B、作物秸秆露天焚烧 C、生活污水集中处理 D、电动公交绿色出行2. 下列有关物质的组成或分类说法正确的是( )A、生铁和钢都属于单质 B、纯碱和烧碱都属于碱 C、高锰酸钾和锰酸钾都属于盐 D、氯酸钾和氯化钾的元素组成相同3. 下列化学实验操作不符合规范的是( )A、将块状固体放入试管中
 B、读取液体体积
B、读取液体体积  C、加热液体
C、加热液体  D、滴加少量液体
D、滴加少量液体  4. 下列说法正确的是( )A、硬水通过煮沸或蒸馏的方法可变为软水 B、纯铜的硬度大于黄铜 C、硝酸铵固体溶于水后,溶液的温度升高 D、物质的热胀冷缩现象是由于分子的大小发生了改变5. 下列有关物质的性质与用途具有对应关系的是( )A、活性炭具有吸附性,可做电极 B、熟石灰具有碱性,可用作发酵粉 C、氩气的化学性质稳定,可用作电光源 D、洗洁精具有乳化作用,可用于去除油污6. 甲、乙两种固体物质的溶解度曲线如图所示,下列说法正确的是( )
4. 下列说法正确的是( )A、硬水通过煮沸或蒸馏的方法可变为软水 B、纯铜的硬度大于黄铜 C、硝酸铵固体溶于水后,溶液的温度升高 D、物质的热胀冷缩现象是由于分子的大小发生了改变5. 下列有关物质的性质与用途具有对应关系的是( )A、活性炭具有吸附性,可做电极 B、熟石灰具有碱性,可用作发酵粉 C、氩气的化学性质稳定,可用作电光源 D、洗洁精具有乳化作用,可用于去除油污6. 甲、乙两种固体物质的溶解度曲线如图所示,下列说法正确的是( )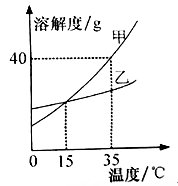 A、甲的溶解度大于乙的溶解度 B、15℃时,溶质的质量分数:甲=乙 C、35℃时,甲、乙的饱和溶液降温均有晶体析出 D、35℃时,将30g甲加入50g水中,可得到80g甲溶液7. 下列关于一氧化碳的叙述正确的是( )A、“低碳生活”就是降低CO的排放 B、高炉炼铁的主要反应原理是高温下用一氧化碳还原铁的氧化物 C、在煤炉上放一盆水可以防止CO中毒 D、实验室常用块状石灰石和稀盐酸反应制CO8. 下列物质提纯所用的实验方法正确的是( )
A、甲的溶解度大于乙的溶解度 B、15℃时,溶质的质量分数:甲=乙 C、35℃时,甲、乙的饱和溶液降温均有晶体析出 D、35℃时,将30g甲加入50g水中,可得到80g甲溶液7. 下列关于一氧化碳的叙述正确的是( )A、“低碳生活”就是降低CO的排放 B、高炉炼铁的主要反应原理是高温下用一氧化碳还原铁的氧化物 C、在煤炉上放一盆水可以防止CO中毒 D、实验室常用块状石灰石和稀盐酸反应制CO8. 下列物质提纯所用的实验方法正确的是( )选项
物质(括号内为杂质)
实验方法
A
H2(HCl)
通过装有氢氧化钠溶液的洗气瓶,干燥
B
Fe(Fe2O3)
加入足量的稀硫酸,结晶
C
CaCO3(CaO)
加入水,过滤
D
CuSO4溶液(H2SO4)
加入足量的铜粉,过滤
A、A B、B C、C D、D9. 下列实验方案,不能达到相应实验目的的是( )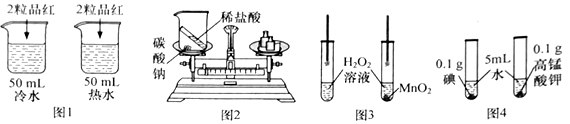 A、图1:探究温度对分子运动快慢的影响 B、图2:验证质量守恒定律 C、图3:探究MnO2能否加快H2O2的分解 D、图4:探究影响物质溶解性的因素10. 在加热条件下,碳和浓硫酸反应的原理为:aC+bH2SO4(浓) cSO2↑+dX+eCO2↑。将1.2g碳与一定质量的浓硫酸混合后加热,固体消失时,消耗硫酸的质量为19.6g,生成SO2、X、CO2的质量分别为12.8g、mg、4.4g。下列说法错误的是( )A、浓硫酸具有强烈的腐蚀性 B、m=3.6g C、X的化学式是H2O D、c︰e=1︰1
A、图1:探究温度对分子运动快慢的影响 B、图2:验证质量守恒定律 C、图3:探究MnO2能否加快H2O2的分解 D、图4:探究影响物质溶解性的因素10. 在加热条件下,碳和浓硫酸反应的原理为:aC+bH2SO4(浓) cSO2↑+dX+eCO2↑。将1.2g碳与一定质量的浓硫酸混合后加热,固体消失时,消耗硫酸的质量为19.6g,生成SO2、X、CO2的质量分别为12.8g、mg、4.4g。下列说法错误的是( )A、浓硫酸具有强烈的腐蚀性 B、m=3.6g C、X的化学式是H2O D、c︰e=1︰1二、填空题
-
11. 从微观的角度了解物质及其变化,有助于更好地认识物质的组成和变化的本质。(1)、下表为部分元素的原子结构示意图:
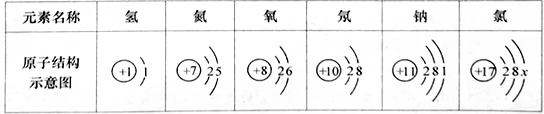
请回答下列问题:
①表中具有相对稳定结构的原子是(填元素符号)。
②氯原子的最外层电子数x为 , 在化学反应中氯原子易(填“得到”或“失去”)电子。
③钠原子失去1个电子形成离子的离子符号为。
(2)、在一定条件下,CO2与氰化氢(HCN)反应可以生成N2 , 反应的微观示意图如下。
①生成物中的氧化物能使澄清的石灰水变浑浊,该物质的化学式为。
②写出上图所示反应的化学方程式:。
三、流程题
-
12. 草酸锌晶体(ZnC2O4·2H2O)是一种白色固体,微溶于水,熔点为100℃。以锌为原料制备草酸锌晶体的一种生产工艺如下:
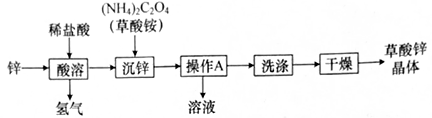 (1)、根据草酸铵的化学式,可推测草酸的化学式是。(2)、“酸溶”过程中发生反应的化学方程式是 , 该反应属于基本反应类型中的反应(3)、“沉锌”过程中发生反应的化学方程式是。(4)、“操作A”的名称是 , 分离出的溶液可用作(写一种用途)。(5)、加热草酸锌晶体可以制备ZnO(ZnCO4·2H2O ZnO+CO↑+CO2↑+2H2O),比较草酸锌晶体的熔点和分解温度,发生装置应选择下图中的装置(填对应装置的字母)。
(1)、根据草酸铵的化学式,可推测草酸的化学式是。(2)、“酸溶”过程中发生反应的化学方程式是 , 该反应属于基本反应类型中的反应(3)、“沉锌”过程中发生反应的化学方程式是。(4)、“操作A”的名称是 , 分离出的溶液可用作(写一种用途)。(5)、加热草酸锌晶体可以制备ZnO(ZnCO4·2H2O ZnO+CO↑+CO2↑+2H2O),比较草酸锌晶体的熔点和分解温度,发生装置应选择下图中的装置(填对应装置的字母)。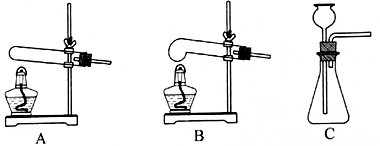
四、科学探究题
-
13. “第三届国际氢能与燃料电池汽车大会”于2018年10月23日在如皋召开。
 (1)、Ⅰ.氢燃料电池
(1)、Ⅰ.氢燃料电池图1所示为氢燃料电池的工作原理:将氢气送到燃料电池中,经过催化剂的作用,通过质子交换膜,再与氧气反应,同时产生电流。请写出氢燃料电池中发生反应的化学方程式:。
(2)、Ⅱ.制氢铁酸锌(ZnFe2O4)可用于循环分解水制取氢气,其中涉及的反应有:
①6ZnFe2O4 6ZnO+ 4Fe3O4+O2↑;
②3ZnO+2Fe3O4+H2O 3ZnFe2O4+H2↑
ZnFe2O4中Fe的化合价为。
(3)、该循环制氢中不断消耗的物质是 , 所得H2和O2的质量比为。(4)、电解水也可制得H2。图2所示装置中,(填“a”或“b”)管中产生的气体为氢气(5)、Ⅲ.储氢在常温和250 kPa下,镧镍合金(LaNi5)吸收氢气生成 LaNi5H7 , 该物质能在一定条件下分解释放出氢气,该储氢原理属于变化。
14. 科学探究和证据推理是化学学科的核心素养。化学兴趣小组对“测定空气中氧气的含量”实验进行探究,并基于证据进行推理分析。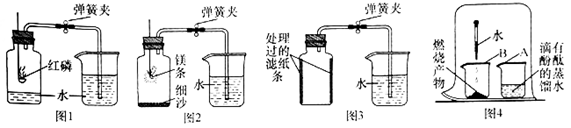 (1)、I.用红磷测定空气中氧气的含量
(1)、I.用红磷测定空气中氧气的含量写出红磷在空气中燃烧的化学方程式:。
(2)、某同学利用图1所示装置进行实验,步骤如下:①用弹簧夹夹紧胶皮管;
②点燃燃烧匙内的红磷,立即伸入瓶中并塞紧瓶塞;
③;
④观察并记录水面的变化情况。
多次实验发现,集气瓶内水平面上升始终小于1/5。
(3)、Ⅱ.用镁条测定空气中氧气的含量某同学进行图2所示实验时发现,产物中有少许黄色固体。
(提出问题)黄色固体是什么呢?
(查阅资料)①氧化镁为白色固体;
②镁能与空气中的反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水反应生成氨气。
(4)、(做出猜想)黄色固体为Mg3N2(实验过程)进行图4所示实验:取燃烧产物于烧杯B中,加入适量水,然后用大烧杯罩住小烧杯A和B。
(实验结论)观察到的现象是 , 据此可推断燃烧产物中含氮化镁(Mg3N2)。
(5)、(反思交流)进行图2所示实验时,在确保规范操作的前提下,该同学所测得的空气中氧气的体积分数(填“大于”“小于”或“等于”)1/5。(6)、Ⅲ.用铁粉测定空气中氧气的含量某同学利用铁生锈的原理,用铁粉测定空气中氧气的含量,实验装置如图3所示。当烧杯中不再有水进入集气瓶时,该同学停止实验。实验开始和结束时所采集的数据如下表:
实验前的体积
实验后的体积
集气瓶内空气
烧杯内水
烧杯内剩余水
250mL
180.0mL
129.5mL
①铁生锈的原理是铁与空气中的发生反应。
②实验时该同学不是将铁粉堆在瓶底,而是将铁粉撒在浸润了氯化钠溶液的滤纸条上,再将滤纸条贴在集气瓶内壁,其目的是。
③该同学所测得的空气中氧气的体积分数为(精确到0.1%)。
④与红磷燃烧法相比,用该法测定空气中氧气含量的主要优点是。
(7)、Ⅳ.拓展应用取2.4g镁条在足量O2和N2的混合气体中完全燃烧,所得固体质量为a g,则a的取值范围是3.3<a<。
五、计算题
-
15. 葡萄糖(C6H12O6)是生命活动中不可缺少的物质,它在人体内能直接参与新陈代谢过程。(1)、葡萄糖中碳、氢、氧三种元素的质量比为(用最简整数比表示)。(2)、5g葡萄糖最多可配制5%的葡萄糖溶液g;配制时所需的玻璃仪器有烧杯、量筒、胶头滴管和。(3)、兴趣小组同学对某葡萄糖样品中葡萄糖的含量进行测定,实验步骤如下:
步骤1 取样品10g于烧杯中,用蒸馏水溶解,得到50mL溶液;
步骤2 加入新制的蓝色氢氧化铜浊液;
步骤3 加热(反应原理:C6H12O6+2Cu(OH)2 C6H12O7+Cu2O↓+2H2O);
步骤4 称量生成的砖红色氧化亚铜(Cu2O)沉淀的质量,称得其质量为7.2g。
计算该样品中葡萄糖的质量分数。(请将解题过程写到答题纸上)
-
-