北京市东城区2018-2019学年九年级上学期化学期末考试试卷
试卷更新日期:2019-03-15 类型:期末考试
一、单选题
-
1. 在我国制碱工业上作出重大贡献的科学家是( )A、若贝尔
 B、门捷列夫
B、门捷列夫  C、拉瓦锡
C、拉瓦锡  D、侯德榜
D、侯德榜  2. 空气中,体积分数约为21%的气体是( )A、氧气 B、氮气 C、稀有气体 D、二氧化碳3. 氢氧化钙的俗称是( )A、生石灰 B、熟石灰 C、石灰石 D、大理石4. 下列符号中,表示2个氯原子的是( )A、2Cl B、2Cl- C、Cl2 D、2Cl25. 下列物质属于氧化物的是( )A、C2H6O B、NaOH C、CO2 D、H2SO46. 不会造成空气污染的气体是( )A、SO2 B、N2 C、CO D、NO27. 下列物质属于纯净物的是( )A、矿泉水 B、自来水 C、蒸馏水 D、食盐水8. NaNO2是一种工业用盐,其中氮元素的化合价是( )A、-3 B、+l C、+3 D、+59. 下列实验操作正确的是( )A、氧气验满
2. 空气中,体积分数约为21%的气体是( )A、氧气 B、氮气 C、稀有气体 D、二氧化碳3. 氢氧化钙的俗称是( )A、生石灰 B、熟石灰 C、石灰石 D、大理石4. 下列符号中,表示2个氯原子的是( )A、2Cl B、2Cl- C、Cl2 D、2Cl25. 下列物质属于氧化物的是( )A、C2H6O B、NaOH C、CO2 D、H2SO46. 不会造成空气污染的气体是( )A、SO2 B、N2 C、CO D、NO27. 下列物质属于纯净物的是( )A、矿泉水 B、自来水 C、蒸馏水 D、食盐水8. NaNO2是一种工业用盐,其中氮元素的化合价是( )A、-3 B、+l C、+3 D、+59. 下列实验操作正确的是( )A、氧气验满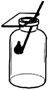 B、检查装置气密性
B、检查装置气密性 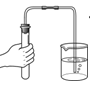 C、点燃酒精灯
C、点燃酒精灯 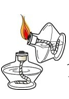 D、稀释浓硫酸
D、稀释浓硫酸 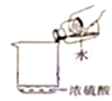 10. 被蚊虫叮咬后,蚊虫分泌出蚁酸使皮肤痛痒,涂抹碱性物质能减轻痛痒。被蚊虫叮咬后,为减轻痛痒,宜涂抹的物质是( )
10. 被蚊虫叮咬后,蚊虫分泌出蚁酸使皮肤痛痒,涂抹碱性物质能减轻痛痒。被蚊虫叮咬后,为减轻痛痒,宜涂抹的物质是( )选项
A
B
C
D
常见物质
葡萄汁
牛奶
苹果汁
牙膏
pH
3.5 —4.5
6.3—6.6
3.0
9.0
A、A B、B C、C D、D11. 铼在元素周期表中的相关信息如右图所示。下列有关说法错误的是( )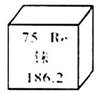 A、铼的元素符号是Re B、铼原子的核内质子数为75 C、铼原子的核外电子数为75 D、铼的相对原子质量为186.2g12. 下列关于甲醇(CH4O)的说法中正确的是( )A、甲醇的相对分子质量为32 B、甲醇由6个原子构成 C、1个甲醇分子中含有2个氢分子 D、甲醇中碳、氢元素质量比为1:113. 下列实验现象描述错误的是( )A、硫在空气中燃烧产生淡蓝色火焰 B、木炭在氧气中剧烈燃烧,生成黑色固体 C、红磷在空气中燃烧产生大量白烟 D、碳酸钠溶液与石灰水混合,出现白色沉淀14. 利用下图所示装置测定空气中氧气含量。下列说法,错误的是( )
A、铼的元素符号是Re B、铼原子的核内质子数为75 C、铼原子的核外电子数为75 D、铼的相对原子质量为186.2g12. 下列关于甲醇(CH4O)的说法中正确的是( )A、甲醇的相对分子质量为32 B、甲醇由6个原子构成 C、1个甲醇分子中含有2个氢分子 D、甲醇中碳、氢元素质量比为1:113. 下列实验现象描述错误的是( )A、硫在空气中燃烧产生淡蓝色火焰 B、木炭在氧气中剧烈燃烧,生成黑色固体 C、红磷在空气中燃烧产生大量白烟 D、碳酸钠溶液与石灰水混合,出现白色沉淀14. 利用下图所示装置测定空气中氧气含量。下列说法,错误的是( )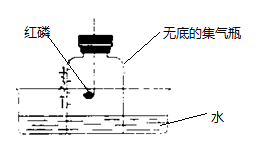 A、可用木炭代替红磷完成该实验 B、点燃红磷后迅速伸入集气瓶并塞紧胶塞 C、氮气不与红磷反应且难溶于水,是此实验设计的依据之一 D、最终集气瓶中液面约上升到刻度1处15. 如图所示,在甲、乙、丙、丁四个盛有100g水的烧杯中,分别放入KNO3固体,充分溶解。
A、可用木炭代替红磷完成该实验 B、点燃红磷后迅速伸入集气瓶并塞紧胶塞 C、氮气不与红磷反应且难溶于水,是此实验设计的依据之一 D、最终集气瓶中液面约上升到刻度1处15. 如图所示,在甲、乙、丙、丁四个盛有100g水的烧杯中,分别放入KNO3固体,充分溶解。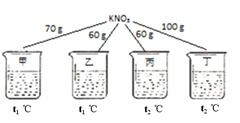

下列关于甲、乙、丙、丁所得溶液的说法正确的是( )
A、溶液质量:乙=丙〈甲〈丁 B、甲、乙、丙、丁均为饱和溶液 C、将甲升温至t2℃,溶液质量增加 D、将丁降温至t1℃,没有有固体析出16. 下列灭火方式错误的是( )A、白磷着火时用沙土盖灭 B、电器着火时立即用棉被盖灭 C、酒精灯失火时用湿抹布盖灭 D、油锅着火时立即盖上锅盖停止加热17. 下列关于物质的用途的叙述正确的是( )A、氧气用作燃料 B、稀硫酸用于除铁锈 C、烧碱用于改良酸性土壤 D、二氧化碳用于供给呼吸18. 分别将浓盐酸、浓硫酸露置在空气中一段时间,下列变化正确的是( )A、溶液的质量均减小 B、溶液中溶质的质量分数均减小 C、溶质的质量均减小 D、溶剂的质量均增大19. 除去下表物质中含有的杂质,所选试剂错误的是( )选 项
物 质
杂 质
除去杂质所选试剂
A
碳酸钙
氧化钙
盐酸
B
氯化钠溶液
碳酸氢钠
盐酸
C
一氧化碳
二氧化碳
氢氧化钠溶液
D
硝酸铜溶液
硝酸银
铜
A、A B、B C、C D、D20. 科学家发现,利用催化剂可有效消除室内装修材料释放的甲醛,其反应的微观示意图如下。下列有关该反应的说法错误的是( )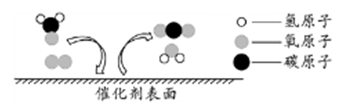 A、属于置换反应 B、可减少甲醛带来的室内空气污染 C、其中催化剂可以加快甲醛的消除 D、化学方程式为:CH2O+O2
A、属于置换反应 B、可减少甲醛带来的室内空气污染 C、其中催化剂可以加快甲醛的消除 D、化学方程式为:CH2O+O2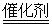 CO2+H2O
21. 下图为CO还原CuO的实验装置图(夹持仪器等略)。已知HCOOH H2O+CO↑。下列说法错误的是( )
CO2+H2O
21. 下图为CO还原CuO的实验装置图(夹持仪器等略)。已知HCOOH H2O+CO↑。下列说法错误的是( ) A、实验中所需CO可现制现用 B、气球的作用是收集尾气,防止污染空气 C、为保证实验成功,实验一开始就点燃酒精灯进行加热 D、此实验B中黑色粉末变为红色,C中石灰水变浑浊22. 小明同学为了探究氯化氢(HCl)的性质,做了如图所示的实验:
A、实验中所需CO可现制现用 B、气球的作用是收集尾气,防止污染空气 C、为保证实验成功,实验一开始就点燃酒精灯进行加热 D、此实验B中黑色粉末变为红色,C中石灰水变浑浊22. 小明同学为了探究氯化氢(HCl)的性质,做了如图所示的实验: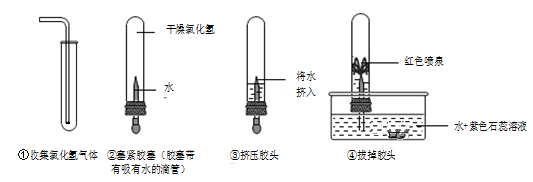
请根据小明的操作和相关现象分析,下列描述错误的是( )
A、氯化氢的密度比空气大 B、氯化氢溶于水使试管内气体压强减小 C、试管内液体的pH<7 D、若将紫色石蕊溶液改为酚酞溶液,可看到蓝色喷泉23. 某实验小组同学用传感器探究氢氧化钠溶液与稀盐酸的反应,向一种溶液中逐滴滴加另一种溶液,用传感器实时获得溶液的pH、温度变化曲线如下图所示。下列说法错误的是( )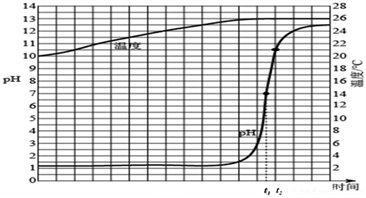 A、t1时,溶液呈中性 B、该反应过程中有热量放出 C、该实验是将稀盐酸滴入氢氧化钠溶液中 D、t2时,溶液中溶质为NaOH和NaCl
A、t1时,溶液呈中性 B、该反应过程中有热量放出 C、该实验是将稀盐酸滴入氢氧化钠溶液中 D、t2时,溶液中溶质为NaOH和NaCl二、填空题
-
24. 粽子是端午节的传统美食,南方粽子用料讲究,除了糯米外, 还有猪肉、咸蛋黄等,味道香糯可口,食之唇齿留香。
 (1)、煮粽子时,在远处能闻到香味。从微观的角度分析, 其原因是。(2)、小海的午餐是粽子,从营养均衡的角度看,他还应该增加的食物是______填字母序号。A、馒头 B、鸡腿 C、青菜25. 食盐的主要成分是NaCl,是人们日常生活中不可缺少的物质。
(1)、煮粽子时,在远处能闻到香味。从微观的角度分析, 其原因是。(2)、小海的午餐是粽子,从营养均衡的角度看,他还应该增加的食物是______填字母序号。A、馒头 B、鸡腿 C、青菜25. 食盐的主要成分是NaCl,是人们日常生活中不可缺少的物质。 (1)、食盐在生活中的用途有(写出一条即可)。(2)、构成氯化钠的微粒是Cl-和(填微粒符号)。26. “饮食与健康”越来越成为百姓的关注点。(1)、某些饼干中会添加碳酸钙,碳酸钙(CaCO3)中钙元素的质量分数的计算式为。(2)、紫薯中富含钙、铁,这里的“钙、铁”是指(填“原子”或“元素”),人体缺铁可能导致。27. 天然气的主要成分是 , 它与 、石油并称为化石燃料.
(1)、食盐在生活中的用途有(写出一条即可)。(2)、构成氯化钠的微粒是Cl-和(填微粒符号)。26. “饮食与健康”越来越成为百姓的关注点。(1)、某些饼干中会添加碳酸钙,碳酸钙(CaCO3)中钙元素的质量分数的计算式为。(2)、紫薯中富含钙、铁,这里的“钙、铁”是指(填“原子”或“元素”),人体缺铁可能导致。27. 天然气的主要成分是 , 它与 、石油并称为化石燃料.
28. 在活动中,同学们认识了神奇的干冰。(1)、干冰可做食品制冷剂,利用了干冰的性质是。(2)、将一小块干冰放入澄清的石灰水中,观察到干冰上下跳动,石灰水变浑浊,发生反应的化学方程式为。29. 水是生活中不可缺少的物质。 (1)、甲图是简易净水器装置,其中小卵石和石英砂的作用是。(2)、乙图为电解水的装置图,试管2中的气体是 , 电解水的化学方程式为。(3)、下列做法中,有利于节约用水或保护水资源的是________(填字母序号)。A、用淘米水浇花 B、生活污水任意排放 C、使用节水型马桶30. 阅读下面科普短文。
(1)、甲图是简易净水器装置,其中小卵石和石英砂的作用是。(2)、乙图为电解水的装置图,试管2中的气体是 , 电解水的化学方程式为。(3)、下列做法中,有利于节约用水或保护水资源的是________(填字母序号)。A、用淘米水浇花 B、生活污水任意排放 C、使用节水型马桶30. 阅读下面科普短文。尿素,是一种白色晶体,化学式为CO(NH2)2 , 属于有机物,它是目前使用量最大的一种化学肥料。
尿素是蛋白质在体内代谢的产物。早在1737~1785年,德国医生博哈夫和法国实验员鲁埃分别通过蒸发尿液获得了尿素。
1811年,英国化学家戴维将一氧化碳和氯气(Cl2)的混合物暴露在日光中,获得光气(COCl2),再将光气与氨作用合成尿素。目前工业上用氨气和二氧化碳在一定条件下合成尿素。
尿素在土壤中酶的作用下,转化成碳酸铵或碳酸氢铵,才能被作物吸收利用,在土壤中不残留任何有害物质,长期施用没有不良影响。尿素在转化前是分子态的,不能被土壤吸附,应防止随水流失。
依据文章内容,回答下列问题:
(1)、尿素中含有种元素。(2)、蒸发尿液可获取尿素,由此可以推断尿素的性质是。(3)、英国化学家戴维将光气与氨作用合成尿素,该反应的化学方程式为:COCl2 + 4NH3 = CO(NH2)2 + 2。(4)、合成尿素的微观示意图如下,该反应的化学方程式为。 (5)、下列说法正确的是_______(填字母序号)。A、蛋白质在体内的代谢产物之一为尿素 B、尿素施用在土壤中,能够被作物直接吸收 C、尿素是一种含氮有机物31. 实验室配制50 g 10%的氯化钠溶液,其操作如下图所示。(水的密度约为1g/cm3)选择A或B作答。若两题均作答,按照选A的答题情况计分。
(5)、下列说法正确的是_______(填字母序号)。A、蛋白质在体内的代谢产物之一为尿素 B、尿素施用在土壤中,能够被作物直接吸收 C、尿素是一种含氮有机物31. 实验室配制50 g 10%的氯化钠溶液,其操作如下图所示。(水的密度约为1g/cm3)选择A或B作答。若两题均作答,按照选A的答题情况计分。①
 ②
②  ③
③  ④
④  ⑤
⑤ 
A
B
⑴①中称量氯化钠的质量为g。
⑵④中玻璃棒的作用是。
⑴③中量取水的体积是mL。
⑵填写⑤中标签
 上的内容。32. 某实验小组设计了如右图所示的实验,从导管向烧杯中通入二氧化碳气体。
上的内容。32. 某实验小组设计了如右图所示的实验,从导管向烧杯中通入二氧化碳气体。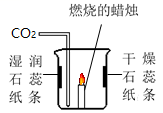 (1)、湿润的石蕊纸条颜色变化是。(2)、蜡烛熄灭,可以验证二氧化碳的性质是________(填字母序号)。A、密度比空气大 B、不燃烧也不支持燃烧 C、能与水反应(3)、在实验中,干燥石蕊纸条的作用是。33. 为了探究硫酸与氢氧化钠是否发生反应,同学们设计并进行了如图所示的实验。
(1)、湿润的石蕊纸条颜色变化是。(2)、蜡烛熄灭,可以验证二氧化碳的性质是________(填字母序号)。A、密度比空气大 B、不燃烧也不支持燃烧 C、能与水反应(3)、在实验中,干燥石蕊纸条的作用是。33. 为了探究硫酸与氢氧化钠是否发生反应,同学们设计并进行了如图所示的实验。 (1)、该反应的化学方程式为。(2)、碱性溶液A是溶液。(3)、滴入过量溶液B后可观察到的现象是 , 该现象能证明硫酸与氢氧化钠发生了化学反应,其理由是。34. 金属在日常生活中应用广泛。(1)、下列金属制品中,利用金属的导热性的是_______(填字母序号)。A、铁锅
(1)、该反应的化学方程式为。(2)、碱性溶液A是溶液。(3)、滴入过量溶液B后可观察到的现象是 , 该现象能证明硫酸与氢氧化钠发生了化学反应,其理由是。34. 金属在日常生活中应用广泛。(1)、下列金属制品中,利用金属的导热性的是_______(填字母序号)。A、铁锅 B、铜导线
B、铜导线  C、黄金首饰
C、黄金首饰  (2)、我国湿法冶金早在西汉时期就已开始, “曾青得铁则化为铜”便是佐证,即将铁浸入硫酸铜溶液得到铜,该反应的化学方程式为。(3)、长时间放置,铁、铜制品锈蚀严重,黄金饰品依然金光灿灿,从物质性质的角度解释其原因。35. 干黄花无毒,而鲜黄花有毒,是因为鲜黄花中含有秋水仙碱。纯秋水仙碱易溶于乙醇,在冷水中易溶、热水中难溶。
(2)、我国湿法冶金早在西汉时期就已开始, “曾青得铁则化为铜”便是佐证,即将铁浸入硫酸铜溶液得到铜,该反应的化学方程式为。(3)、长时间放置,铁、铜制品锈蚀严重,黄金饰品依然金光灿灿,从物质性质的角度解释其原因。35. 干黄花无毒,而鲜黄花有毒,是因为鲜黄花中含有秋水仙碱。纯秋水仙碱易溶于乙醇,在冷水中易溶、热水中难溶。 (1)、秋水仙碱的乙醇溶液中,溶剂是。(2)、秋水仙碱在水中的溶解度随温度升高而(填“增大”或“减小”)。36. 三种家庭常用清洁剂的信息如下表所示:
(1)、秋水仙碱的乙醇溶液中,溶剂是。(2)、秋水仙碱在水中的溶解度随温度升高而(填“增大”或“减小”)。36. 三种家庭常用清洁剂的信息如下表所示:清洁剂



名称
洁厕灵
彩漂液
漂白水
有效成分
HCl
H2O2
NaClO(次氯酸钠)
(1)、洁厕灵可用于清除水垢(主要成分为CaCO3),该反应的化学方程式为。(2)、使用彩漂液时过氧化氢分解释放出活性氧,反应的化学方程式为。(3)、洁厕灵和漂白水混合后, HCl与NaClO会发生反应,产生有毒气体氯气(Cl2),同时生成水和由两种元素组成的盐,该盐是。37. 同学们学习铁的化学性质,完成了下面的实验。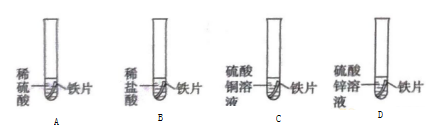 (1)、能观察到气泡产生的实验有(填字母序号)。(2)、实验A中反应的化学方程式为。(3)、上面的实验中有一个不发生反应,其原因是。
(1)、能观察到气泡产生的实验有(填字母序号)。(2)、实验A中反应的化学方程式为。(3)、上面的实验中有一个不发生反应,其原因是。三、流程题
-
38. 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
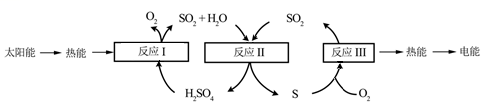 (1)、该过程实现了将太阳能转化为热能、化学能,最终转化为。(2)、反应I属于基本反应类型中的。(3)、反应II中化合价发生变化的元素是。(4)、反应III是在点燃条件完成的,化学方程式为:。39. 高锰酸钾(KMnO4)是一种常用化学试剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的过程如下图所示:
(1)、该过程实现了将太阳能转化为热能、化学能,最终转化为。(2)、反应I属于基本反应类型中的。(3)、反应II中化合价发生变化的元素是。(4)、反应III是在点燃条件完成的,化学方程式为:。39. 高锰酸钾(KMnO4)是一种常用化学试剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的过程如下图所示: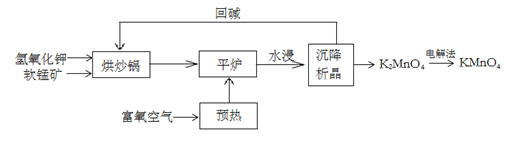 (1)、在“烘炒锅”中进行原料混合,发生的是(填“物理变化”或“化学变化”)。混合前应将软锰矿粉碎,其作用是 。(2)、在平炉中发生反应得到K2MnO4 , 参加反应的物质有。
(1)、在“烘炒锅”中进行原料混合,发生的是(填“物理变化”或“化学变化”)。混合前应将软锰矿粉碎,其作用是 。(2)、在平炉中发生反应得到K2MnO4 , 参加反应的物质有。四、实验题
-
40. 根据下列实验装置图回答问题:
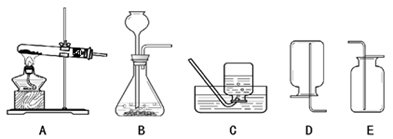 (1)、实验室用A装置制取O2 , 该反应的化学方程式 , 选用C装置收集氧气的原因是。(2)、实验室制取CO2 , 应选用的发生和收集装置是 , 检验CO2已收集满的方法是:用燃着的火柴放在 , 观察到火焰熄灭,则收集满。41. 同学们用下图所示实验探究可燃物燃烧的条件。已知:白磷的着火点为40℃。
(1)、实验室用A装置制取O2 , 该反应的化学方程式 , 选用C装置收集氧气的原因是。(2)、实验室制取CO2 , 应选用的发生和收集装置是 , 检验CO2已收集满的方法是:用燃着的火柴放在 , 观察到火焰熄灭,则收集满。41. 同学们用下图所示实验探究可燃物燃烧的条件。已知:白磷的着火点为40℃。A
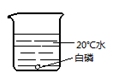 B
B 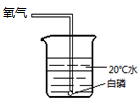 C
C 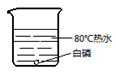 D
D 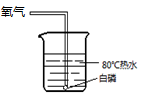 (1)、能验证可燃物燃烧需要氧气的实验现象是。(2)、A—D中,可不做的实验是。42. 实验室制取氧气并进行相关实验。(1)、用过氧化氢溶液和二氧化锰混合制氧气。下列取用二氧化锰的操作正确的是(填字母序号)。
(1)、能验证可燃物燃烧需要氧气的实验现象是。(2)、A—D中,可不做的实验是。42. 实验室制取氧气并进行相关实验。(1)、用过氧化氢溶液和二氧化锰混合制氧气。下列取用二氧化锰的操作正确的是(填字母序号)。 (2)、探究带火星的木条复燃情况,部分实验数据记录如下:
(2)、探究带火星的木条复燃情况,部分实验数据记录如下:氧气体积分数(%)
30
40
60
70
带火星的木条
不变
稍亮
复燃
复燃
根据上述实验数据得出的结论是 。在集气瓶中注入占其容积50%的水(如图所示),用排水法收集氧气,将瓶内的水排尽,用带火星的木条在该集气瓶中进行实验,推测实验现象并说明理由。。
五、科学探究题
-
43. 铁与水蒸气在高温条件下反应生成一种铁的氧化物和一种气体单质,实验装置如下图所示。
 (1)、试管尾部放一团湿棉花的目的是。(2)、用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到上方空中。说明生成的气体是。(3)、探究试管中剩余固体成分。
(1)、试管尾部放一团湿棉花的目的是。(2)、用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到上方空中。说明生成的气体是。(3)、探究试管中剩余固体成分。(查阅资料)
①几种常见铁的氧化物的颜色、状态及能否被磁铁吸引如下表所示。
常见铁的氧化物
FeO
Fe2O3
Fe3O4
颜色、状态
黑色粉末
红棕色粉末
黑色晶体
能否被磁铁吸引
否
否
能
②四氧化三铁能与稀硫酸反应:Fe3O4+4H2SO4=FeSO4+Fe2(SO4)3+4H2O
(初步实验验证)
试管中剩余固体为黑色,能全部被磁铁吸引,则剩余固体一定不含氧化物、。
(4)、(猜想与假设)猜想一:剩余固体是Fe3O4;
猜想二:剩余固体是。
(5)、(继续进行实验)实验操作
实验现象
实验结论
取少量黑色固体于试管中,滴加足量的稀硫酸。
猜想一不成立,
猜想二成立。
(6)、(实验结论)铁和水蒸气反应的化学方程式为。44. 市场上的加碘食盐通常加入的是碘酸钾(KIO3),替代了原来的碘化(KI),因为碘化钾容易被氧气氧化。为探究不同条件下KI与O2的反应,进行如下系列实验。(查阅资料)①碘单质(I2)遇淀粉液变蓝。②部分酸、碱、盐通常在水溶液中以离子形式存在,如:盐酸中存在H+和Cl-。
(进行实验)
实验1 将不同浓度的KI溶液置于纯氧中,放置相同时间后观察,现象如下表:
装置
烧杯中的液体
现象
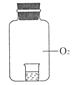
①2 mL 0.15%KI溶液+5滴淀粉液
无明显变化
②2 mL 1.5%KI溶液+5滴淀粉液
溶液变蓝
③2 mL 15%KI溶液+5滴淀粉液
溶液变蓝,颜色较②深
实验2 将相同浓度的KI溶液加入不同浓度的稀盐酸后置于纯氧中,5分钟后观察,现象如下表:
装置
烧杯中的液体
现象

④ 2 mL 15%KI溶液+5滴淀粉液+2mL蒸馏水
无明显变化
⑤ 2 mL 15%KI溶液+5滴淀粉液+2 mL1% 盐酸
溶液变蓝
⑥ 2 mL 15%KI溶液+5滴淀粉液+2 mL 10% 盐酸
溶液变蓝,颜色较⑤深
(1)、[解释与结论]实验1的目的是。
(2)、实验2中通过对比⑤和⑥,得出的结论是。(3)、实验2中,KI在盐酸的作用下与O2反应的化学方程式如下,补全该反应的化学方程式:4KI+O2+4HCl=4KCl+2+。(4)、[反思与评价]实验④中加2mL蒸馏水的作用是。
(5)、某同学将实验⑥中2 mL10% 盐酸替换成2 mL10% NaCl溶液,5分钟后溶液颜色无明显变化,从离子角度分析,由此得出的结论是。