四川省德阳五中2018-2019学年高二下学期化学第一次月考试卷
试卷更新日期:2019-03-13 类型:月考试卷
一、 选择题
-
1. 下列有关能源的理解或说法错误的是( )A、煤、石油、太阳能、风能等均属于新能源 B、乙醇是一种可再生能源,可代替汽油作为汽车燃料 C、氢气是最轻的燃料,是具有广阔发展前景的能源 D、研发开采可燃冰水合甲烷的技术,可大大缓解能源危机2. 若某原子的外围电子排布式为4d15s2 , 则下列说法正确的是( )A、该元素位于周期表中第五周期IIIB族 B、该元素原子价电子数为2个 C、该元素为非金属元素 D、该元素原子N能层共有8个电子3. 下列有关物质性质的比较中,不正确的是( )A、 热稳定性:
 B、 碱性:
B、 碱性:  C、 酸性:
C、 酸性:  D、 熔点:
D、 熔点:  4. 下列分子均属于极性分子且中心原子均为sp3杂化的是( )A、
4. 下列分子均属于极性分子且中心原子均为sp3杂化的是( )A、 、
、  B、
B、 、
、  C、
C、 、
、  D、
D、 、
、  5. 下列分子或离子的空间构型为平面三角形的是( )A、
5. 下列分子或离子的空间构型为平面三角形的是( )A、 B、
B、 C、
C、 D、
D、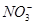 6. 下列事实不能用化学平衡移动原理解释的是( )A、光照新制的氯水时,溶液的pH逐渐减小 B、 加催化剂,使
6. 下列事实不能用化学平衡移动原理解释的是( )A、光照新制的氯水时,溶液的pH逐渐减小 B、 加催化剂,使 和
和  在一定条件下转化为
在一定条件下转化为  C、可用浓氨水和氢氧化钠固体快速制取氨气
D、 增大压强,有利于
C、可用浓氨水和氢氧化钠固体快速制取氨气
D、 增大压强,有利于  和
和 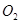 反应生成
反应生成  7. 下列化合物中的化学键中,既有离子键又有共价键的是( )A、
7. 下列化合物中的化学键中,既有离子键又有共价键的是( )A、 B、NaCl
C、
B、NaCl
C、 D、HCl
8. 下列内容与结论相对应的是( )
D、HCl
8. 下列内容与结论相对应的是( )内 容
结 论
A
H2O(g)变成H2O(l)
△S>0
B
硝酸铵溶于水可自发进行
因为△S<0
C
一个反应的△H>0,△S>0
反应一定不自发进行
D
H2(g)+F2(g)=2HF(g)△H=-271kJ•mol-1
△S=8J•mol-1•K-1
反应在任意外界条件下均可自发进行
A、A B、B C、C D、D9. 恒温恒容条件下,不能表明反应:2NO2(g)⇌2NO(g)+O2(g) 已达平衡状态的是( )A、容器中颜色不再改变 B、混合气平均相对分子质量不再改变 C、混合气密度不再改变 D、单位时间内生成n mol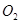 的同时生成2n mol
的同时生成2n mol  10. 已知:键能数据如下:
10. 已知:键能数据如下:H-H
Cl-Cl
H-Cl
键能(kJ/mol)
436
243
a
下列有关H2(g)与Cl2(g)反应生成HCl(g)的说法正确的是( )
A、 与
与  反应的热化学方程式:
反应的热化学方程式:  B、
B、 与
与  反应 一定是放热反应
C、若
反应 一定是放热反应
C、若  ,则反应生成2molHCl时的
,则反应生成2molHCl时的  D、反应物的总能量小于生成物的总能量
11. 对于反应N2(g)+3H2(g)⇌2NH3(g);△H<0,下列研究目的和示意图相符的是( )A、
D、反应物的总能量小于生成物的总能量
11. 对于反应N2(g)+3H2(g)⇌2NH3(g);△H<0,下列研究目的和示意图相符的是( )A、 目的:压强对反应的影响(P2>P1)
B、
目的:压强对反应的影响(P2>P1)
B、 目的:温度对反应的影响
C、
目的:温度对反应的影响
C、 目的:平衡体系增加N2对反应的影响
D、
目的:平衡体系增加N2对反应的影响
D、 目的:催化剂对反应的影响
12. 在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)⇌zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时,测得A的浓度降低为0.30mol/L.下列有关判断正确的是( )A、C的体积分数增大了 B、平衡向正反应方向移动 C、A的转化率降低了 D、
目的:催化剂对反应的影响
12. 在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)⇌zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时,测得A的浓度降低为0.30mol/L.下列有关判断正确的是( )A、C的体积分数增大了 B、平衡向正反应方向移动 C、A的转化率降低了 D、 13. 有关晶体的结构如图所示,下列说法中不正确的是( )
13. 有关晶体的结构如图所示,下列说法中不正确的是( ) A、在NaCl 晶体中,距Na 最近的Cl 形成正八面体 B、在
A、在NaCl 晶体中,距Na 最近的Cl 形成正八面体 B、在 晶体中,每个晶胞平均占有4 个
晶体中,每个晶胞平均占有4 个  C、在金刚石晶体中,碳原子与碳碳键个数的比为1:2
D、该气态团簇分子的分子式为EF或FE
14. 下列溶液中有关物质的量浓度关系错误的是( )A、pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(M+)+c(H+)=c(OH-)+c(A-) B、pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) C、物质的量浓度相等的CH3COONa、CH3COOH溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) D、0.1mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
C、在金刚石晶体中,碳原子与碳碳键个数的比为1:2
D、该气态团簇分子的分子式为EF或FE
14. 下列溶液中有关物质的量浓度关系错误的是( )A、pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(M+)+c(H+)=c(OH-)+c(A-) B、pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) C、物质的量浓度相等的CH3COONa、CH3COOH溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) D、0.1mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)二、非选择题
-
15. 如图1为周期表的一部分,表中所列的字母分别代表一种化学元素。回答下列问题:
 (1)、f的基态原子核外电子排布式。(2)、在c2a4分子中,c为杂化,c与c间存在的共价键类型有两种。(3)、ci2与ce2比较,沸点较高的是(写分子式)。(4)、将氨水滴入到j的硫酸盐溶液中,先产生蓝色沉淀,然后沉淀逐渐溶解并得到深蓝色溶液。深蓝色溶液中是由于存在(写结构式)(5)、j的金属晶体的晶胞如图2所示,则一个晶胞中每个j原子周围与它最接近且距离相等的j共有的个数是个,已知该元素的相对原子质量为64,单质晶体的密度为ρg•cm-3 , 阿伏加德罗常数的值为NA , 试求铜的金属半径为 pm(用含NA、ρ的表达式表达)。16. 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
(1)、f的基态原子核外电子排布式。(2)、在c2a4分子中,c为杂化,c与c间存在的共价键类型有两种。(3)、ci2与ce2比较,沸点较高的是(写分子式)。(4)、将氨水滴入到j的硫酸盐溶液中,先产生蓝色沉淀,然后沉淀逐渐溶解并得到深蓝色溶液。深蓝色溶液中是由于存在(写结构式)(5)、j的金属晶体的晶胞如图2所示,则一个晶胞中每个j原子周围与它最接近且距离相等的j共有的个数是个,已知该元素的相对原子质量为64,单质晶体的密度为ρg•cm-3 , 阿伏加德罗常数的值为NA , 试求铜的金属半径为 pm(用含NA、ρ的表达式表达)。16. 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:t℃
700
800
830
1000
1200
K
0.6
0.9
1.0
1.7
2.6
回答下列问题:
(1)、该反应的化学平衡常数表达式为K=(2)、该反应为 反应(选填“吸热”“放热”).(3)、能判断该反应是否达到化学平衡状态的依据是 ______ .A、容器中压强不变 B、混合气体中c(CO)不变 C、v正(H2)=v逆(H2O) D、c(CO2)=c(CO)(4)、某温度下,平衡浓度符合c(CO2)•c(H2)=c(CO).c(H2O),试判断此时的温度为 ℃.在此温度下2L密闭容器中进行反应CO2(g)+H2(g)⇌CO(g)+H2O(g),CO2(g)和H2(g)的起始量均为2.0mol,达到平衡时CO2的转化率为 .(5)、在密闭容器中进行反应①Fe(s)+CO2(g)⇌FeO(s)+CO(g)△H1=akJ•mol-1反应②2CO(g)+O2(g)⇌2CO2(g)△H2=b kJ•mol-1
反应③2Fe(s)+O2(g)⇌2FeO(s)△H3
则△H3= (用含a、b的代数式表示).
17. 某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下: (1)、称取13.0 g草酸晶体,配成250.00 mL水溶液.此操作过程必须用到的2种定量仪器是 和 .(2)、量取草酸溶液25.00 mL放入锥形瓶中,用0.2000 mol/L的酸性KMnO4溶液滴定.
(1)、称取13.0 g草酸晶体,配成250.00 mL水溶液.此操作过程必须用到的2种定量仪器是 和 .(2)、量取草酸溶液25.00 mL放入锥形瓶中,用0.2000 mol/L的酸性KMnO4溶液滴定.①量取25.00 mL草酸溶液
②酸化KMnO4溶液的酸应为 .(选填“盐酸”或“稀硫酸”或“稀硝酸”)
③配平离子方程式:□MnO4-+□H2C2O4+□H+→□Mn2++□CO2↑+□H2O
④滴定达到终点的标志是 .
(3)、在上述实验中,下列操作一定会造成测定结果偏低的是 ______ .A、称取13.0 g草酸晶体时,将草酸晶体放在托盘天平右盘 B、锥形瓶水洗后未用草酸溶液润洗 C、读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数 D、盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失.18. 工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl2•6H2O),其过程为:
已知:Ⅰ.有关氢氧化物沉淀的pH:
氢氧化物
Fe(OH)3
Fe(OH)2
开始沉淀的pH
1.5
6.5
沉淀完全的pH
3.7
9.7
Ⅱ.SrCl2•6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
(1)、操作①需要加快反应速率,措施有充分搅拌和(写一种).碳酸锶与盐酸反应的离子方程式 .(2)、在步骤②-③的过程中,将溶液的pH值由1调节至;宜用的试剂为 .A.1.5 B.3.7 C.9.7 D.氨水 E.氢氧化锶粉末 F.碳酸钠晶体
(3)、操作③中所得滤渣的主要成分是 (填化学式).(4)、工业上用热风吹干六水氯化锶,适宜的温度是______A、50~60℃ B、80~100℃ C、100℃以上19. 按要求回答下列问题:(1)、甲醇是一种重要的化工原料,有着重要的用途和应用前景。工业上一般采用下列两种反应合成甲醇:反应I:CO(g)+2H2(g)⇌CH3OH(g);△H1
反应II:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g);△H2
①上述反应中原子利用率百分之百的是(填“I”或“Ⅱ”)
②下表所列数据是反应I在不同温度下的化学平衡常数(K)
温度
250℃
300℃
350℃
K
2.041
0.270
0.012
由表中数据判断△H10,T℃时,将2mol CO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,此时T为。
(2)、已知在常温常压下:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:。