上海市杨浦区2019届高三上学期化学一模考试试卷
试卷更新日期:2019-03-12 类型:高考模拟
一、单选题
-
1. 下列分子中的所有原子均在同一平面内的是()A、甲烷 B、乙烯 C、乙酸 D、甲苯2. 原子晶体具有的性质是()A、熔点高 B、易导热 C、能导电 D、有延展性3. 有关合金的说法正确的是()A、生铁比纯铁熔点高 B、钢比纯铁硬 C、合金不具有导热性 D、合金都不含非金属元素4. 实验室收集下列气体的方法肯定与 相同的是()A、
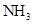 B、
B、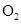 C、HCl
D、CH2=CH2
5. 在“ 和 ”的变化过程中,被破坏的作用力依次是()A、范德华力、范德华力 B、范德华力、共价键 C、共价键、离子键 D、共价键、共价键6. 下列反应可用:H++OH—→H2O表示的是()A、
C、HCl
D、CH2=CH2
5. 在“ 和 ”的变化过程中,被破坏的作用力依次是()A、范德华力、范德华力 B、范德华力、共价键 C、共价键、离子键 D、共价键、共价键6. 下列反应可用:H++OH—→H2O表示的是()A、 B、
B、 C、
C、 D、
D、 7. 同温同压下, 气体和 气体恰好完全反应,生成160mL X气体,X的分子式是()A、
7. 同温同压下, 气体和 气体恰好完全反应,生成160mL X气体,X的分子式是()A、 B、
B、 C、
C、 D、
D、 8. 通入 能引起下列溶液的颜色变化,其中 的作用和 使溴水褪色相同的是( )A、品红褪色 B、NaOH酚酞溶液褪色 C、石蕊试液变红 D、酸性
8. 通入 能引起下列溶液的颜色变化,其中 的作用和 使溴水褪色相同的是( )A、品红褪色 B、NaOH酚酞溶液褪色 C、石蕊试液变红 D、酸性 溶液褪色
9. 微信热传的“苯宝宝表情包”可看作是由苯衍生的物质配以相应文字形成的(如图),苯不属于()
溶液褪色
9. 微信热传的“苯宝宝表情包”可看作是由苯衍生的物质配以相应文字形成的(如图),苯不属于() A、环烃 B、芳烃 C、不饱和烃 D、烃的衍生物10. 已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高。则下列溶液沸点最高的是()A、
A、环烃 B、芳烃 C、不饱和烃 D、烃的衍生物10. 已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高。则下列溶液沸点最高的是()A、 的蔗糖溶液
B、
的蔗糖溶液
B、 的
的  溶液
C、
溶液
C、 的
的  溶液
D、
溶液
D、 的
的  溶液
11. 时, . 溶液显碱性,是因为()A、
溶液
11. 时, . 溶液显碱性,是因为()A、 电离出了
电离出了  B、
B、 结合了水电离的
结合了水电离的  C、
C、 和水反应生成了NaOH
D、
和水反应生成了NaOH
D、 促进了水的电离
12. 对钢铁析氢腐蚀和吸氧腐蚀的比较,合理的是()A、负极反应不同 B、正极反应相同 C、析氢腐蚀更普遍 D、都是电化学腐蚀13. 由物理变化引起的颜色改变是()A、光照使
促进了水的电离
12. 对钢铁析氢腐蚀和吸氧腐蚀的比较,合理的是()A、负极反应不同 B、正极反应相同 C、析氢腐蚀更普遍 D、都是电化学腐蚀13. 由物理变化引起的颜色改变是()A、光照使 和
和  的混合气体变浅
B、浓硫酸使蔗糖变黑
C、溴水中加苯振荡使水层褪色
D、通电使
的混合气体变浅
B、浓硫酸使蔗糖变黑
C、溴水中加苯振荡使水层褪色
D、通电使  溶液变浅
14. 下列各组物质混合时,前者过量和不足时,发生不同化学反应的是()A、NaOH溶液和
溶液变浅
14. 下列各组物质混合时,前者过量和不足时,发生不同化学反应的是()A、NaOH溶液和 溶液
B、稀
溶液
B、稀 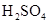 与
与  C、Al和NaOH溶液
D、氨水与
C、Al和NaOH溶液
D、氨水与  溶液
15. 汽车尾气中的氮氧化合物 与大气中的 发生如下作用,形成一种雾霾。
溶液
15. 汽车尾气中的氮氧化合物 与大气中的 发生如下作用,形成一种雾霾。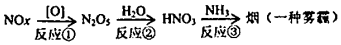
有关该雾霾的叙述错误的是()
A、该雾霾中含硝酸铵固体 B、反应 是非氧化还原反应
C、
是非氧化还原反应
C、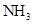 是形成该雾霾的催化剂
D、
是形成该雾霾的催化剂
D、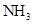 可能来自过度施用氮肥
16. 用 溶液腐蚀印刷电路板上的铜,所得溶液中加入过量的铁粉,充分反应后,最终溶液中的金属阳离子()A、只含
可能来自过度施用氮肥
16. 用 溶液腐蚀印刷电路板上的铜,所得溶液中加入过量的铁粉,充分反应后,最终溶液中的金属阳离子()A、只含 B、含
B、含  和
和  C、含
C、含  和
和  D、只含
D、只含  17. 硫酸工业的有关叙述错误的是()A、硫铁矿磨成粉末,可加快反应速率 B、煅烧硫铁矿时鼓入较大量空气,可提高原料利用率 C、接触室(发生反应:
17. 硫酸工业的有关叙述错误的是()A、硫铁矿磨成粉末,可加快反应速率 B、煅烧硫铁矿时鼓入较大量空气,可提高原料利用率 C、接触室(发生反应: )使用热交换器,可充分利用能量
D、接触室出来的气体被浓硫酸(
)使用热交换器,可充分利用能量
D、接触室出来的气体被浓硫酸(  溶于其中)吸收后,可直接排放到空气中
18. 某制碱厂的生产流程示意图如下:
溶于其中)吸收后,可直接排放到空气中
18. 某制碱厂的生产流程示意图如下:
下列分析正确的是()
A、该制碱法是侯氏制碱法 B、反应 中包含复分解反应
C、X中只含有
中包含复分解反应
C、X中只含有  和
和  D、理论上,生产过程中无需补充
D、理论上,生产过程中无需补充 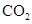 19. 某溶液中可能含有 、 、 、 、 分别取样: 测得溶液显弱酸性; 滴加氯水和淀粉至过量,始终无明显现象。为确定该溶液的组成,必须的检验方法或试剂是()A、焰色反应 B、NaOH溶液(加热) C、
19. 某溶液中可能含有 、 、 、 、 分别取样: 测得溶液显弱酸性; 滴加氯水和淀粉至过量,始终无明显现象。为确定该溶液的组成,必须的检验方法或试剂是()A、焰色反应 B、NaOH溶液(加热) C、 酸化
酸化  溶液
D、
溶液
D、 气体
气体
二、多选题
-
20. 向漂粉精的水溶液中加入或通入少量下列物质,不能增强其漂白能力的是()A、稀盐酸 B、
 粉末
C、
粉末
C、 固体
D、
固体
D、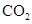 气体
气体
三、填空题
-
21. 因在航空、核能、电池等高技术领城的重要作用一一锂被称为“21世纪的能源金属”。完成下列填空:(1)、锂位于元素周期表的。锂的很多化学性质与镁相似。请依据元素周期律进行解释:。(2)、氢化锂(LiH)是离子化合物,写出其阴离子的电子式。LiH中阴离子半径大于阳离子半径,其原因是。工业上用 制取锂的化合物及金属锂。(3)、碳原子核外电子有种不同能量的电子,其中有两个电的能量最高且能量相等,这两个电子所处的轨道是(4)、用 、氨水和液溴制备 的流程如下:

①合成时,除生成LiBr外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式:
②溴化锂的溶解度随温度变化曲线如图所示,请补全从溶液中得到 晶体的实验步骤、、过滤、用乙醉洗涤,干燥。
 22. 煤是重要能源。燃煤会释放 、CO等有毒气体,消除有毒气体的研究和实践从未停止。
22. 煤是重要能源。燃煤会释放 、CO等有毒气体,消除有毒气体的研究和实践从未停止。完成下列填空:
(1)、Ⅰ 用 消除CO、 和CO可发生如下两个反应:反应 :
反度 :
写出反应 的平衡常数表达式:;一定条件下的密闭容器中,两反应均达平衡后,若使反应 的K减小,需要改变的反应条件是 , 则反应 的K(选填编号)、反应 的以 (选填号)
a、增大
b、减小
c、不变
d、无法判断
(2)、补全下图中反应 的能量变化示意图(即,注明生成物能量的大致位置及反应热效应数值) (3)、下图是不同温度下,CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。写出两种降低 生成量的措施
(3)、下图是不同温度下,CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。写出两种降低 生成量的措施 (4)、Ⅱ 溶液可除去煤中以黄铁矿(FeS2)形式存在的硫元素,反应如下:
(4)、Ⅱ 溶液可除去煤中以黄铁矿(FeS2)形式存在的硫元素,反应如下:。
标出电子转移的数目和方向:还原产物是
(5)、检验上述反应中 是否消耗完的实验方案:(6)、该方法的优点之一是 易再生。向反应后的溶液中通入 , 就能达到使 再生的目的,方便且价康。23. 烯烃在金属卡宾催化下发生烯烃复分解反应,化学家将其形象地描迟为“交换交谊舞舞伴。其原理如下:2C2H5CH=CHCH3
 C2H5CH=CHC2H5+CH3CH=CHCH3
C2H5CH=CHC2H5+CH3CH=CHCH3以下是由烯烃 合成酯M和酯N的路线:

完成下列填空:
(1)、Q中官能团的名称: , 的反应条件:(2)、写出 的合成路线合成路线的表示方式为:甲
 乙
乙  目标产物(3)、E的结构简式为:。 的反应类型:反应(4)、写出 的化学反应方程式(5)、有机物X的笨环只有一个侧链且不含甲基,写出X的结构简式:(6)、有机物Y是D的同分异构体,1mol Y与足量的新制氢氧化铜完全反应得到2mol沉淀,Y烷基上的一氯取代物只有一种,写出Y的结构简式
目标产物(3)、E的结构简式为:。 的反应类型:反应(4)、写出 的化学反应方程式(5)、有机物X的笨环只有一个侧链且不含甲基,写出X的结构简式:(6)、有机物Y是D的同分异构体,1mol Y与足量的新制氢氧化铜完全反应得到2mol沉淀,Y烷基上的一氯取代物只有一种,写出Y的结构简式四、实验题
-
24. 工业上通过电解精制饱和食盐水来制备NaOH、 、 ,再合成盐酸。完成下列填空(1)、粗盐提纯:为除去粗盐中的 、 、 ,向粗盐溶液中依次加入稍过量的NaOH溶液、 , 过滤后,再向滤液中加入适量 , 再蒸发。(2)、电解饱和食盐水: ,电解10L饱和食盐水,若阴极收集到标准状况下 (填气体化学式),则溶液 (设溶液体积、温度不变、忽略生成物间的反应)。
工业制盐酸:利用 和 化合,所得产物再溶于水的方法得盐酸,生产流程如下:
 (3)、为确保 完全反应,合成塔中 略大于 。写出一条 必须反应完全的理由:(4)、盐酸浓度测定;可用滴定法,用盐酸滴定已知质量 的溶液。过程如下:准确称量一定质量的 固体于锥形瓶中,加蒸馏水使其溶解,滴加指示剂X,用待测盐酸滴定,接近终点时,加热锥形瓶,煮沸液体2min,冷却至室温,继续滴定至终点,记录消耗盐酸的体积。重复上述过程三次,计算盐酸浓度。
(3)、为确保 完全反应,合成塔中 略大于 。写出一条 必须反应完全的理由:(4)、盐酸浓度测定;可用滴定法,用盐酸滴定已知质量 的溶液。过程如下:准确称量一定质量的 固体于锥形瓶中,加蒸馏水使其溶解,滴加指示剂X,用待测盐酸滴定,接近终点时,加热锥形瓶,煮沸液体2min,冷却至室温,继续滴定至终点,记录消耗盐酸的体积。重复上述过程三次,计算盐酸浓度。已知:指示剂X的变色范围是 ; ,饱和 水溶液
本测定用的仪器有锥形瓶、烧杯、玻璃棒、
(5)、本测定的反应原理是(用化学方程式表示)。(6)、接近终点时煮沸反应混合物的目的是(7)、盛放 固体的锥形瓶不干燥,对实验结果的影响是(填“偏大”“偏小”或“无影响”)。
-