福建省泉州市2018-2019学年高二上学期化学期末考试试卷
试卷更新日期:2019-03-12 类型:期末考试
一、选择题
-
1. 化学与生活生产密切相关。下列说法中错误的是()A、施肥时,铵态氮肥不能与草木灰(含K2CO3)混合使用 B、夏天冰箱保鲜食品的原理是降低温度,减小化学反应速率 C、施用适量石膏(CaSO4·2H2O)可降低盐碱地(含较多NaCl、Na2CO3)的碱性 D、将海水直接电解可获得 Mg及Cl2等单质2. 下列物质溶于水后溶液显酸性的是()A、NaHCO3 B、NH4NO3 C、Na2SO4 D、CH3OH3. 下列离子方程式中,属于盐类水解反应的是()A、Na2CO3溶液:CO32-+2H2O
 H2CO3 +2OH-
B、NaHCO3溶液:HCO3-+H2O
H2CO3 +2OH-
B、NaHCO3溶液:HCO3-+H2O  CO32-+H3O+
C、NaHS溶液:HS-+H2O
CO32-+H3O+
C、NaHS溶液:HS-+H2O  H2S+OH-
D、KF溶液:F-+H2O=HF+OH-
4. 下表中物质的分类组合完全正确的是()
H2S+OH-
D、KF溶液:F-+H2O=HF+OH-
4. 下表中物质的分类组合完全正确的是()编号
A
B
C
D
强电解质
KNO3
H2SO4
BaSO4
HClO4
弱电解质
NH3·H2O
CaCO3
HClO
C2H5OH
非电解质
SO2
Al
H2O
CH3COOH
A、A B、B C、C D、D5. 一定体积的稀盐酸与过量的铝条反应,为了减缓反应速率且不影响生成氢气的总量,可向盐酸中加入适量的()A、NaCl固体 B、CH3COOK溶液 C、Na2CO3溶液 D、CuCl2 溶液6. 下列说法或表示方法中错误的是()A、在同温同压下,等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 B、室温下,pH=2的盐酸与pH=12的氨水等体积混合,溶液呈碱性 C、氢氧化钡晶体与氯化铵晶体的反应属于吸热反应 D、常温下,0.1mol·L-1的NaOH溶液和0.06mol·L-1的H2SO4溶液等体积混合,混合溶液的pH=27. 下列事实能用勒夏特列原理解释的是()A、SO2氧化成SO3的反应,往往需要使用催化剂 B、H2、I2(g)、HI平衡混合气加压后颜色加深 C、工业上采用高压条件合成氨气 D、在硫酸亚铁溶液中加入铁粉以防止氧化变质8. 为证明某一元酸HR是弱酸,下列实验方法错误的是()A、室温时,测定0.01mol·L-1的HR溶液的pH=4 B、室温时,往NaR溶液中滴加无色酚酞试液,溶液变红色 C、相同条件下,对浓度均为0.1 mol·L-1盐酸和HR溶液进行导电性实验 D、0.1mol·L-1的HR溶液与同体积0.1 mol·L-1的氢氧化钠溶液恰好完全反应9. 常温下,下列各组离子在指定溶液中,一定能大量共存的是()A、在pH=13的溶液中:K+、Mg2+、Cl-、SO32- B、c(H+)/c(OH-)=1×1012的溶液:Cu2+、Na+、Cl-、NO3- C、无色溶液中:Fe3+、NH4+、Cl-、SO42- D、由水电离出c(OH-)=1.0×10-12mol·L-1的溶液中:Al3+、NH4+、Cl-、SO42-10. 下列有关装置图的叙述中正确的是()装置①
 装置②
装置② 
装置③
 装置④
装置④  A、用装置①给铜镀银,则b极为单质银,电解质溶液为AgNO3溶液 B、装置②的总反应式:Cu+2Fe3+=Cu2++2Fe2+ C、装置③中钢闸门应与电源的负极相连被保护,该方法叫做外加电流的阴极保护法 D、装置④中插入海水中的铁棒,越靠近底端腐蚀越严重11. 下列实验操作能达到目的的是()A、在中和热的测定实验中,可将稀盐酸换成浓硫酸 B、欲除去水垢中的CaSO4 , 可先用碳酸钠溶液处理,再用盐酸处理 C、用标准盐酸滴定未知浓度的NaOH溶液,用蒸馏水洗净滴定管后,可直接装入标准盐酸进行滴定 D、配制氯化铁溶液时,将氯化铁固体溶解在较浓的硫酸中再加水稀释12. 下列有关电解质溶液的说法正确的是()A、向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中导电粒子的数目减少 B、升高CH3COONa溶液的温度,溶液中
A、用装置①给铜镀银,则b极为单质银,电解质溶液为AgNO3溶液 B、装置②的总反应式:Cu+2Fe3+=Cu2++2Fe2+ C、装置③中钢闸门应与电源的负极相连被保护,该方法叫做外加电流的阴极保护法 D、装置④中插入海水中的铁棒,越靠近底端腐蚀越严重11. 下列实验操作能达到目的的是()A、在中和热的测定实验中,可将稀盐酸换成浓硫酸 B、欲除去水垢中的CaSO4 , 可先用碳酸钠溶液处理,再用盐酸处理 C、用标准盐酸滴定未知浓度的NaOH溶液,用蒸馏水洗净滴定管后,可直接装入标准盐酸进行滴定 D、配制氯化铁溶液时,将氯化铁固体溶解在较浓的硫酸中再加水稀释12. 下列有关电解质溶液的说法正确的是()A、向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中导电粒子的数目减少 B、升高CH3COONa溶液的温度,溶液中 增大
C、盐酸与氨水恰好完全反应,则溶液中c(H+)=c(OH-)
D、向AgCl的饱和溶液中加入少量AgNO3溶液,则溶液中c(Ag+)·c(Cl-)保持不变
13. 常温下,几种弱酸的电离平衡常数如下表所示,下列说法正确的是()
增大
C、盐酸与氨水恰好完全反应,则溶液中c(H+)=c(OH-)
D、向AgCl的饱和溶液中加入少量AgNO3溶液,则溶液中c(Ag+)·c(Cl-)保持不变
13. 常温下,几种弱酸的电离平衡常数如下表所示,下列说法正确的是()化学式
HCOOH
H2CO3
HCN
电离平衡常数
K=1.8×10-4
K1=4.3×10-7 K2=5.6×10-11
K=4.9×10-10
A、酸性强弱顺序是:HCOOH>HCN>H2CO3 B、物质的量浓度均为0.1mol·L-1的HCOONa溶液和NaCN溶液,pH大小顺序:HCOONa<NaCN C、HCOOH的电离平衡常数表达式为K= D、H2CO3溶液和NaCN溶液反应的离子方程式为H2CO3+2CN-=2HCN+CO32-
14. 在一定条件下,密闭容器中进行反应CH4(g)+H2O(g)
D、H2CO3溶液和NaCN溶液反应的离子方程式为H2CO3+2CN-=2HCN+CO32-
14. 在一定条件下,密闭容器中进行反应CH4(g)+H2O(g) CO(g)+3H2(g),测得CH4的体积百分含量随温度和压强的变化如图所示。下列说法正确的是()
CO(g)+3H2(g),测得CH4的体积百分含量随温度和压强的变化如图所示。下列说法正确的是()  A、p1>p2 B、ΔH<0 C、加入催化剂可以提高甲烷的转化率 D、恒温下,缩小容器体积,平衡后CH4浓度减小15. 将等物质的量的A、B混合于2L的密闭容器中,发生下列反应 ,经4min后达平衡,测得D的浓度为1.0mol·L-1 , c(A):c(B)=2:3,以C表示的平均速率υ(C)=0.125mol·L-1·min-1 , 下列说法错误的是()A、反应速率υ(A)=0.25mol·L-1·min-1 B、该反应方程式中,x=1 C、4 min时,B的物质的量为2mol D、该反应的平衡常数K=
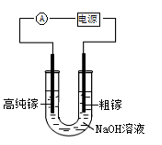
A、p1>p2 B、ΔH<0 C、加入催化剂可以提高甲烷的转化率 D、恒温下,缩小容器体积,平衡后CH4浓度减小15. 将等物质的量的A、B混合于2L的密闭容器中,发生下列反应 ,经4min后达平衡,测得D的浓度为1.0mol·L-1 , c(A):c(B)=2:3,以C表示的平均速率υ(C)=0.125mol·L-1·min-1 , 下列说法错误的是()A、反应速率υ(A)=0.25mol·L-1·min-1 B、该反应方程式中,x=1 C、4 min时,B的物质的量为2mol D、该反应的平衡常数K=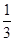 16. 含有某些含氧酸根杂质的粗KOH溶液可用电解法提纯,其工作原理如图所示。下列有关说法正确的是()
16. 含有某些含氧酸根杂质的粗KOH溶液可用电解法提纯,其工作原理如图所示。下列有关说法正确的是() A、装置右侧发生的电极反应式为:
A、装置右侧发生的电极反应式为: B、通电后阴极区附近溶液pH会减小
C、m是电源负极
D、纯净的KOH溶液从b出口导出
17. 硫代硫酸钠溶液与稀硫酸可发生反应: ,某同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。
B、通电后阴极区附近溶液pH会减小
C、m是电源负极
D、纯净的KOH溶液从b出口导出
17. 硫代硫酸钠溶液与稀硫酸可发生反应: ,某同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下
实验编号
反应温度/℃
Na2S2O3溶液
稀H2SO4
H2O
V/mL
c/(mol·L-1)
V/mL
c/(mol·L-1)
V/mL
①
25
5
0.1
10
0.1
5
②
25
5
0.2
5
0.1
10
③
25
5
0.1
10
0.2
5
④
50
5
0.2
5
0.1
10
⑤
50
8
0.1
5
0.1
V1
下列说法正确的是()
A、实验①和实验④中最先出现浑浊的是实验① B、其他条件不变时,探究温度对化学反应速率的影响,应选择实验③和实验④ C、选择实验①和实验③,测定混合液变浑浊的时间,可探究硫酸浓度对化学反应速率的影响 D、选择实验④和实验⑤,可探究Na2S2O3的浓度对反应速率的影响,则V1=10mL18. 室温下,将0.1000mol·L-1盐酸滴入20.00mL未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示,下列说法正确的是() A、b点处的溶液中c(Cl-)>c(M+)>c(OH-)>c(H+) B、室温下,MOH的电离平衡常数Kb为1×10-5 C、c点处的溶液中c(M+)=c(Cl-)=c(H+)=c(OH-) D、d点处的溶液中c(MOH)+c(H+)=c(OH-)
A、b点处的溶液中c(Cl-)>c(M+)>c(OH-)>c(H+) B、室温下,MOH的电离平衡常数Kb为1×10-5 C、c点处的溶液中c(M+)=c(Cl-)=c(H+)=c(OH-) D、d点处的溶液中c(MOH)+c(H+)=c(OH-)二、计算题
-
19.(1)、S8分子可形成单斜硫和斜方硫,转化过程如下:S(s,单斜)
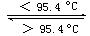 S(s,斜方) ΔH=-0.398kJ·mol-1 , 则S(单斜)、S(斜方)相比,较稳定的是(填“S(单斜)”或“S(斜方)”)。
(2)、下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJ·mol-1)
S(s,斜方) ΔH=-0.398kJ·mol-1 , 则S(单斜)、S(斜方)相比,较稳定的是(填“S(单斜)”或“S(斜方)”)。
(2)、下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJ·mol-1)化学键
H—H
H—Cl
键能
436
431
热化学方程式:H2(g)+Cl2(g)=2HCl(g) ΔH=-183kJ·mol-1 , 则Cl2的键能为kJ·mol-1。
(3)、标准状况下,6.72LC2H2(g)在O2(g)中完全燃烧生成CO2(g)和H2O(l),放出389.7kJ热量,请写出表示C2H2燃烧热的热化学方程式:。(4)、已知:C(石墨,s)+O2(g)=CO2(g) ΔH1=-a kJ·mol-1H2(g)+1/2O2(g)=H2O(l) ΔH2=-bkJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH3=-ckJ·mol-1
计算C(石墨,s)与H2(g)反应生成1molCH4(g)的ΔH为kJ·mol-1(用含a,b,c的式子表示)。
(5)、由N2O和NO反应生成N2和NO2的能量变化如图所示。则反应过程中,每生成2molN2理论上放出的热量为。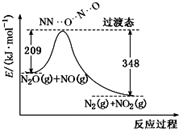
三、填空题
-
20. 电化学原理在能量转换、金属冶炼等方面应用广泛。
图①
 图②
图② 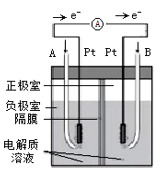
图③
 (1)、图①是碱性锌锰电池,在负极发生反应的物质是(填“Zn”或“MnO2”),正极发生反应(填“氧化”或“还原”)。(2)、图②是碱性电解质的氢氧燃料电池,B极通入的气体为 , A极发生的电极反应式。(3)、电解法可以提纯粗镓,具体原理如图③所示:
(1)、图①是碱性锌锰电池,在负极发生反应的物质是(填“Zn”或“MnO2”),正极发生反应(填“氧化”或“还原”)。(2)、图②是碱性电解质的氢氧燃料电池,B极通入的气体为 , A极发生的电极反应式。(3)、电解法可以提纯粗镓,具体原理如图③所示:①粗镓与电源极相连(填“正”或“负”)。
②镓在阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2- , GaO2-在阴极放电的电极反应式。
(4)、由下列物质冶炼相应金属,须采用电解法的是(选填字母序号)。a.NaCl
b.Fe2O3
c.Cu2S
d.Al2O3
21. 二甲醚(CH3OCH3),是一种易燃气体。主要作为甲基化试剂和各类气雾推进剂,在制药、染料、农药工业中有许多独特的用途。其制备方法之一可由H2和CO合成:2CO(g)+ 4H2(g) CH3OCH3(g)+H2O(g) ΔH<0(1)、该反应的ΔS0(填“>”、“<”或“=”)。(2)、在恒温恒容容器中,不能判断该反应达到化学平衡状态的依据是(选填字母序号)。a.二甲醚和水蒸气的体积比等于1︰1
b.容器中压强保持不变
c.υ正(H2)=4υ逆(CH3OCH3)
d.容器中一氧化碳的物质的量不再改变
(3)、在密闭容器中,反应达到平衡后下列措施能加快反应速率并提高CO转化率的是(选填字母序号)。a.将H2O(g)从体系中分离出来
b.缩小容器体积,使体系压强增大
c.加入合适的催化剂
d.升高体系温度
(4)、T℃时,在2L密闭容器中,充入4molCO和8molH2发生反应,测得H2的物质的量随时间变化如图中状态Ⅰ(图中实线)所示:
①T℃时,在状态Ⅰ的条件下,反应达到C点时体系处于平衡状态,以H2表示该反应的平均速率υ(H2)= , CO的转化率是 , 反应的平衡常数KⅠ=。
②若仅改变某一条件,测得H2物质的量随时间变化如图状态Ⅱ所示,则KⅠKⅡ(填“>”、“<”或“=”)。
③若仅改变某一条件时,测得H2的物质的量随时间变化如图状态Ⅲ所示,则改变的条件可能是。
22. 常温下,某水溶液M中存在的粒子有Na+、A2-、HA-、H+、OH-、H2O和H2A。根据题意回答下列问题:(1)、H2A为酸(填“强”或“弱”),往H2A溶液中加水会使 c(H+)/c(H2A)的值(填“增大”、“减小”或“不变”)。(2)、若M是由一种溶质组成的溶液,则M的溶质可以是Na2A或。①Na2A的水溶液pH(填“<”、“>”或“=”)7,
原因是:(用离子方程式表示)
②往Na2A溶液中加入可抑制其水解(选填字母序号)。
a.氯化铵固体
b.KOH固体
c. 水
d.升高温度
③已知Ksp(CuA)=1.3×10-36 , 往20mL1mol·L-1Na2A溶液中加入10mL1mol·L-1CuCl2溶液,混合后溶液中的Cu2+浓度为mol·L-1。(忽略A2-的水解)
(3)、若溶液M由10mL1.00mol·L-1H2A溶液与10mL1.00mol·L-1NaOH溶液混合而成,下列关于溶液M的说法正确的是(选填字母序号)。a.c(A2-)+c(HA-)+c(H2A)=1mol·L-1
b.若溶液显酸性,则c(Na+)>c(HA->c(H+)>c(A2-)>c(OH-)
c.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-)
d.25℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
(4)、浓度均为0.1mol·L-1的Na2A、NaHA混合溶液中: =。四、工业流程
-
23. 回收的废旧锌锰干电池经过处理后可得到锰粉(含MnO2、Mn(OH)2、Fe和炭粉等),由锰粉为主要原料制备高性能磁性材料碳酸锰(MnCO3)的工艺流程如下:

已知:①2H2SO4+MnO2+2FeSO4=MnSO4+Fe2(SO4)3+2H2O
②部分氢氧化物的Ksp(近似值)如下表(25 ℃)
物质
Mn(OH)2
Fe(OH)2
Fe(OH)3
Ksp
10-13
10-17
10-38
根据上图流程及有关数据回答下列问题。
(1)、锰粉酸溶时,过量FeSO4所起的作用为。(2)、往滤液1中先加入H2O2的目的是氧化Fe2+ , 该反应的离子方程式为 , 后加入氨水的目的是调节pH除去杂质离子,使滤液中的杂质离子沉淀完全(残留在溶液中的离子浓度≤ l0-5 mol·L-1),常温下测得溶液中c(Mn2+)=0.1mol·L-1 , 则需调节溶液的pH范围为。(3)、沉锰工序中,加入氨水的目的是(从化学平衡移动的角度解释) , 沉锰工序中判断沉淀已经洗涤干净的实验操作是。(4)、沉锰后废液中的主要成分为。五、实验题
-
24. 化学兴趣小组用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
①称量1.0 g样品溶于水,配成250mL溶液;
②用碱式滴定管准确量取25.00mL所配溶液于锥形瓶中,滴加2~3滴酚酞溶液;
③用0.1000mol·L-1的标准盐酸滴定并重复三次,每次实验数据记录如下:
滴定次数
待测液体积/mL
所消耗盐酸标准溶液的体积/mL
滴定前
滴定后
①
25.00
1.50
21.40
②
25.00
2.50
22.60
③
25.00
0.60
23.20
(1)、称量时,样品应放在称量(选填字母序号)。a.小烧杯中
b.洁净纸片上
c.托盘上
(2)、如图是某次滴定时的滴定管中的液面,其读数为mL。 (3)、判断滴定终点到达时的现象为。(4)、若出现下列情况,测定结果偏高的是(选填字母序号)。
(3)、判断滴定终点到达时的现象为。(4)、若出现下列情况,测定结果偏高的是(选填字母序号)。a.滴定前用蒸馏水冲洗锥形瓶
b.滴定过程中振荡锥形瓶时不慎将瓶内溶液溅出
c.滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管在滴定前有气泡,滴定后气泡消失
(5)、通过计算可知该烧碱样品的纯度为。(杂质不与酸反应)。
-
-