2016-2017学年江西省赣中南五校联考高三上学期开学化学试卷
试卷更新日期:2017-04-24 类型:开学考试
一、选择题
-
1. (已知HCO3﹣+AlO2﹣+H2O═CO32﹣+Al(OH)3↓;将足量的KHCO3溶液不断滴入含等物质的量的KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与滴入的KHCO3溶液体积的关系可表示为( )A、
 B、
B、 C、
C、 D、
D、 2. 将反应5IO3﹣+I﹣+6H+⇌3I2+3H2O设计成如图所示的原电池.开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转.下列判断不正确的是( )
2. 将反应5IO3﹣+I﹣+6H+⇌3I2+3H2O设计成如图所示的原电池.开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转.下列判断不正确的是( ) A、开始加入少量浓硫酸时,乙中石墨电极上发生氧化反应 B、开始加入少量浓硫酸时,同时在甲、乙烧杯中都加入淀粉溶液,只有乙烧杯中溶液变蓝 C、电流计读数为零时,反应达到化学平衡状态 D、两次电流计指针偏转方向相反3. 短周期主族元素A、B、C、D、E的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,E原子最外层电子数是B原子内层电子数的3倍,也是C原子最外层电子数的3倍,B、D原子最外层电子数之和等于C、E原子最外层电子数之和.下列说法正确的是( )A、原子半径C>D>E,三者形成的简单离子中D离子的半径最小 B、元素A所形成的氢化物常温下一定为气态 C、元素C、 D、E在自然界中均不能以游离态存在D.元素B的氧化物对应的水化物一定为强酸4. 具有下列电子排布式的原子中,半径最小的是( )A、ls22s22p63s23p3 B、1s22s22p3 C、1s22s2sp2 D、1s22s22p63s23p45. 某溶液中含有HCO3﹣、Na+、Ba2+、NO3﹣4种离子,若向其中加入少量Na2O2固体后溶液中离子浓度基本保持不变的是( )A、HCO3﹣ B、Na+ C、Ba2+ D、NO3﹣6. 某学生对碱性工业废水样品进行研究,其实验操作或结论的描述,正确的是( )A、将废水加入紫色石蕊试剂中检验酸碱性 B、用玻璃棒蘸取废水样品,蘸在润湿的pH试纸上测定其pH C、测得该废水样品的pH=10,则废水样品中c(OH﹣)=10﹣10 mol/L D、该工业废水中c(H+)<c(OH﹣)7. 现有四种元素的基态原子的电子排布式如下:
A、开始加入少量浓硫酸时,乙中石墨电极上发生氧化反应 B、开始加入少量浓硫酸时,同时在甲、乙烧杯中都加入淀粉溶液,只有乙烧杯中溶液变蓝 C、电流计读数为零时,反应达到化学平衡状态 D、两次电流计指针偏转方向相反3. 短周期主族元素A、B、C、D、E的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,E原子最外层电子数是B原子内层电子数的3倍,也是C原子最外层电子数的3倍,B、D原子最外层电子数之和等于C、E原子最外层电子数之和.下列说法正确的是( )A、原子半径C>D>E,三者形成的简单离子中D离子的半径最小 B、元素A所形成的氢化物常温下一定为气态 C、元素C、 D、E在自然界中均不能以游离态存在D.元素B的氧化物对应的水化物一定为强酸4. 具有下列电子排布式的原子中,半径最小的是( )A、ls22s22p63s23p3 B、1s22s22p3 C、1s22s2sp2 D、1s22s22p63s23p45. 某溶液中含有HCO3﹣、Na+、Ba2+、NO3﹣4种离子,若向其中加入少量Na2O2固体后溶液中离子浓度基本保持不变的是( )A、HCO3﹣ B、Na+ C、Ba2+ D、NO3﹣6. 某学生对碱性工业废水样品进行研究,其实验操作或结论的描述,正确的是( )A、将废水加入紫色石蕊试剂中检验酸碱性 B、用玻璃棒蘸取废水样品,蘸在润湿的pH试纸上测定其pH C、测得该废水样品的pH=10,则废水样品中c(OH﹣)=10﹣10 mol/L D、该工业废水中c(H+)<c(OH﹣)7. 现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5
则下列有关比较中正确的是( )
A、第一电离能:④>③>②>① B、原子半径:④>③>②>① C、电负性:④>③>②>① D、最高正化合价:④>③=②>①二、解答题
-
8. 某研究小组以粗盐和碳酸氢铵(NH4HCO3)为原料,采用以下流程制备纯碱和氯化铵.
已知盐的热分解温度:NH4HCO3 36℃; NaHCO3 270℃; NH4Cl 340℃; Na2CO3>850℃
 (1)、粗盐中含有Ca2+、Mg2+、SO42﹣等杂质离子,使用的试剂有:①NaOH ②BaCl2③HCl ④Na2CO3 , 其加入的顺序合理的是
(1)、粗盐中含有Ca2+、Mg2+、SO42﹣等杂质离子,使用的试剂有:①NaOH ②BaCl2③HCl ④Na2CO3 , 其加入的顺序合理的是A.①③④②B.①②④③C.③②④①D.①②③④
过滤中用到玻璃棒的作用是
(2)、如何判断粗盐中SO42﹣是否已除尽?;(3)、从NaCl溶液到沉淀1的过程中,需蒸发浓缩.在加入固体NH4HCO3之前进行蒸发浓缩优于在加入NH4HCO3之后,原因是;(4)、写出沉淀1受热分解的化学方程式;(5)、为提高NH4Cl产品的产率和纯度,需在滤液中加入氨水,理由是;步骤X包括的操作有;
(6)、采用“甲醛法”测定工业产品中氯化铵的纯度(假定杂质不与甲醛反应),反应原理为:4NH4Cl+6HCHO→(CH2)6N4+4HCl+6H2O 某技术人员称取1.5g该样品溶于水,加入足量的甲醛并加水配成100mL溶液.从中取出10mL,滴入酚酞再用0.1mol/L的NaOH溶液滴定,到滴定终点时消耗NaOH溶液25.00mL.则该样品中氯化铵的质量分数为 .9. 甲、乙两种单质,A、B、C、D、E、F六种化合物之间可以按下面框图进行反应,已知:C为红褐色沉淀,E为白色沉淀,F焰色反应为黄色
 (1)、写出甲、乙、B、E化学式:
(1)、写出甲、乙、B、E化学式:甲:乙:B:E:
(2)、写出①②③反应化学方程式:①
②
③ .
10. 甲是一种可用于净水和膨化食品的盐,由A、B、C、D、E五种短周期元素组成.甲溶于水后可电离出三种离子,其中一种是由A、B形成的10电子阳离子.A元素原子核内质子数比E的少l,D、E同主族.某同学为探究甲的组成而进行如下实验:①取mg甲的晶体溶于蒸馏水,配成500mL溶液;
②取少量甲溶液于试管中,逐滴滴入Ba(OH)2溶液,生成沉淀的物质的量与滴入Ba(OH)2溶液体积的关系如图所示;

③取20mL甲溶液于试管中,加入过量NaOH溶液后加热并收集产生的气体,然后折算成标准状况下的体积为224mL.
回答下列问题:
(1)、D在元素周期表中的位置为 .(2)、经测定晶体甲的摩尔质量为453g•mol﹣1 , 其中阳离子和阴离子物质的量之比为1:1. 则晶体甲的化学式为 .(3)、图象中V(Oa):V(ab):V(bc)= .(4)、写出ab段发生反应的离子方程式: .(5)、配成的甲溶液物质的量浓度是 .三、[化学-选修2:化学与技术]
-
11. 〔化学﹣﹣选修2:化学与技术〕
锌锰电池(俗称干电池)在生活中的用量很大.两种锌锰电池的构造如图(a)所示.回答下列问题:
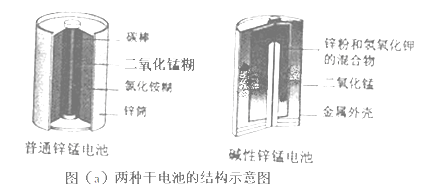 (1)、普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2═Zn(NH3)2Cl2+2MnOOH
(1)、普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2═Zn(NH3)2Cl2+2MnOOH①该电池中,负极材料主要是 , 电解质的主要成分是 , 正极发生的主要反应是 .
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是 .
(2)、图(b)表示回收利用废旧普通锌锰电池工艺(不考虑废旧电池中实际存在的少量其他金属).
①图(b)中产物的化学式分别为A , B .
②操作a中得到熔块的主要成分是K2MnO4 . 操作b中,绿色的K2MnO4溶液反应生成紫色溶液和一种黑褐色固体,该反应的离子方程式为 .
③采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是(填化学式).
四、[化学选修--3:物质结构与性质]
-
12. 周期表前四周期的元素a、b、c、d、e,原子序数依次增大.A的核外电子总数与其电子层数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同主族,e的最外层只有1个电子,但次外层有18个电子.回答下列问题:(1)、b、c、d中第一电离能最大的是(填元素符号),e的价层电子轨道示意图为 .(2)、a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为;分子中既含有极性共价键,又含有非极性共价键的化合物是(填化学式,写两种).(3)、这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是;酸根呈三角锥结构的酸是 . (填化学式)(4)、c和e形成的一种离子化合物的晶体结构如图1,则e离子的电荷为 .
 (5)、这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,阳离子呈轴向狭长的八面体结构(如图2所示).该化合物中阴离子为 , 阳离子中存在的化学键类型有;该化合物加热时首先失去的组分是 , 判断理由是 .
(5)、这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,阳离子呈轴向狭长的八面体结构(如图2所示).该化合物中阴离子为 , 阳离子中存在的化学键类型有;该化合物加热时首先失去的组分是 , 判断理由是 .
五、[化学-选修5:有机化学基础]
-
13. 化合物Ⅰ(C11H12O3)是制备液晶材料的中间体之一,其分子中含有醛基和酯基.Ⅰ可以用E和H在一定条件下合成:

已知以下信息:
A的核磁共振氢谱表明其只有一种化学环境的氢;R﹣CH═CH2
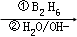 R﹣CH2CH2OH
R﹣CH2CH2OH化合物F苯环上的一氯代物只有两种;
通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基.
回答下列问题:
(1)、A的化学名称为 .(2)、D的结构简式为 .(3)、E的分子式为 .(4)、F生成G的化学方程式为 , 该反应类型为 .(5)、I的结构简式为 .(6)、I的同系物J比I相对分子质量小14,J的同分异构体中能同时满足如下条件:①苯环上只有两个取代基,②既能发生银镜反应,又能和饱和NaHCO3溶液反应放出CO2 , 共有种(不考虑立体异构).J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出J的这种同分异构体的结构简式 .
-
-