2016-2017学年湖北省襄阳市枣阳七中高三上学期开学化学试卷
试卷更新日期:2017-04-24 类型:开学考试
一、单选题
-
1. 将0.1摩尔镁、铝混合物粉末溶于200mL0.5mol/L的硫酸中,反应一段时间后,再加入150mL2mol/L的氢氧化钠溶液,待反应完全,此时溶液中大量存在的是( )A、Na+ , Mg2+ B、Na+ , AlO2﹣ C、Mg2+ , AlO2﹣ D、Al3+ , Mg2+2. 下列配制的溶液浓度偏高的是( )A、配制盐酸用量筒量取盐酸时俯视刻度线 B、配制盐酸定容时,仰视容量瓶刻度线 C、称量4 g NaOH配制0.1 mol/L NaOH溶液1 000 mL时,砝码错放左盘 D、NaOH溶解后未经冷却即注入容量瓶至刻度线3. 使用容量瓶配制溶液,下列操作不正确的是( )A、使用容量瓶前检查它是否漏水 B、容量瓶用蒸馏水洗净后,再用待配溶液润洗 C、盖好瓶塞,用食指顶住瓶塞,用另一只手指托住瓶底,把容量瓶倒转和摇动几次 D、容量瓶不能长期存放配制好的溶液4. 我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金…其水甚强,五金八石皆能穿第,惟玻璃可盛.”这里的“强水”是指( )A、氨水 B、硝酸 C、醋 D、卤水5. 离子反应方程式H++OH﹣=H2O,可表示的化学反应是( )A、Cu(OH)2和稀H2SO4反应 B、HNO3和Mg(OH)2反应 C、Ba(OH)2溶液和HCl溶液混合 D、NaOH和CH3COOH反应6. 将a mol的铁铜混合物投入到200mL 2mol/L的稀HNO3中,充分反应后金属无剩余,下列说法正确的是( )A、被还原的HNO3不可能是 mol B、溶液中剩余的n(NO3﹣)≤(0.4﹣ )mol C、溶液中不可能同时存在Fe2+、Fe3+、Cu2+ D、被还原的硝酸为0.8a mol时,则溶液中一定含有Fe2+7. 下列物质属于纯净物的是( )A、苯 B、天然气 C、汽油 D、煤8. 下列物质在空气中久置会发生变质,且在变质过程中,既有氧化还原反应发生,又有非氧化还原反应发生的是( )A、氢氧化钠固体 B、氯化钠固体 C、金属钠 D、生石灰9. 下列表格中各项都正确的一组是( )
类别选项
碱
盐
电解质
非电解质
A
明矾
食盐
石墨
醋酸
B
纯碱
CaCO3
NH3•H2O
Fe
C
烧碱
小苏打
BaSO4
干冰
D
KOH
CuSO4
Na2SO4
NaClO
A、A B、B C、C D、D10. 下列物质的转化在给定条件下能实现的是( )A、Na Na2O2 Na2CO3 B、MgCO3 MgCl2溶液 Mg C、Fe Fe2O3 Fe2(SO4)3 D、SiO2 SiCl4 Si11. 设NA为阿伏加德罗常数的值.下列说法正确的是( )A、1 L 1 mol•L﹣1的NaClO溶液中含有ClO﹣的数目为NA B、78 g苯含有CC双键的数目为3NA C、常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA D、标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA12. 分别用一定量等量的铁与足量的稀硫酸及足量的CuO制备单质铜,有人设计了以下两种方案:①Fe H2 Cu,②CuO CuSO4 Cu.对制备得到Cu的量,下列判断正确的( )
A、一样多 B、①多 C、②多 D、无法判断13. 从南方往北方长途运输水果时,常常将浸泡有高锰酸钾溶液的硅藻土放置在盛放水果的容器中,其目的是( )A、利用高锰酸钾溶液吸收水果产生的乙烯,防止水果早熟 B、利用高锰酸钾溶液吸收水果周围的氧气,防止水果腐烂 C、利用高锰酸钾溶液的氧化性,催熟水果 D、利用高锰酸钾溶液杀死水果周围的细菌,防止水果霉变14. 在标准状况下,容积为1L的密闭容器中刚好可以盛放a个N2分子和b个H2分子组成的混合气体,则阿伏加德罗常数的近似值可以表示为( )A、a+b B、22.4 (a+b)×6.02×1023 C、 ×1023 D、22.4 (a+b)15. 下列正确的叙述有( )①CO2、NO2、P2O5均为酸性氧化物
②Ca(HCO3)2、Fe(OH)3、FeCl2均可由化合反应制得
③碘晶体、氯化钠晶体分别分散到酒精中,所形成的分散系为:溶液、胶体
④灼热的炭与CO2反应、Ba(OH)2•8H2O与NH4Cl的反应均既属于氧化还原反应,又是吸热反应
⑤需要通电才可进行的有:电解、电泳、电离、电镀、电化腐蚀.
A、2个 B、3个 C、4个 D、5个16. 设NA为阿伏加德罗常数,则下列说法中正确的是( )A、常温常压下,1mol氨基(﹣NH2)所含有的电子总数为9NA B、常温常压下,等体积等物质的量浓度的Na2S溶液和Na2SO4溶液的阳离子总数相等 C、在31g白磷分子中含有NA个P﹣P键 D、硬脂酸、软脂酸不是乙酸的同系物17. 下列物质中混有的少量杂质,所选用的试剂及操作方法正确的是( )物质
杂质(少量)
试剂和操作方法
A
O2
H2O(蒸汽)
通过浓H2SO4
B
CO2
CO
点燃
C
KCl固体
KClO3
加入MnO2并加热
D
KNO3溶液
Ba(NO3)2溶液
加入适量的Na2SO4溶液,过滤
A、A B、B C、C D、D18. 当一小块金属钠久置在潮湿的空气中,可能有如下现象产生:①生成白色粉未;②表面变暗;③生成白色块状固体;④发生潮解,表面产生液体.这些现象的先后顺序为( )A、①②③④ B、②③④① C、②①③④ D、④②③①19. 下列离子方程式中不正确的是( )A、氢氧化钡溶液与硫酸混合:Ba2++2OH﹣+2H++SO42﹣═BaSO4↓+2H2O B、铁粉与硝酸银溶液反应:Fe+2Ag+═Fe2++2Ag C、氯化铝溶液与过量的氨水反应:Al3++4NH3•H2O═AlO2﹣+4NH4++2H2O D、氯气通入冷的氢氧化钠溶液中:Cl2+2OH﹣═Cl﹣+ClO﹣+H2O20. 下列各组离子中的离子,能在溶液中大量共存的是( )A、Na+、Mg2+、Cl﹣、OH﹣ B、H+、Ca2+、CO32﹣、NO3﹣ C、Cu2+、K+、SO42﹣、NO3﹣ D、Na+、H+、OH﹣、Ca2+21. 下列说法正确的是( )A、氧化还原反应一定有氧元素参加 B、失电子难的原子其得电子的能力一定强 C、金属单质只具有还原性 D、失电子越多,该物质的还原性就越强22. 下列实验装置设计正确、且能达到目的是( ) A、实验Ⅰ:制备金属钠 B、实验Ⅱ:制取氢氧化亚铁并观察其颜色 C、实验Ⅲ:制取少量的氢氧化铝 D、实验Ⅳ:比较两种物质的热稳定性23. 设NA为阿伏加德罗常数,下列叙述中正确的是( )A、足量铁在氯气中反应,1mol铁失去的电子数为2 NA B、标准状况下22.4 L H2中含中子数为2 NA C、1 L Imol/L的盐酸溶液中,所含氯化氢分子数为NA D、常温下46 g NO2和N2O4混合气体中含有原子数为3NA24. 在自来水的生产中,常通入适量氯气进行杀菌消毒,氯气与水反应的产物之一是盐酸.市场上有些不法商贩为牟取暴利,利用自来水冒充纯净水桶装出售,为辨别真伪,可用以鉴别的一种试剂是( )A、氢氧化钠溶液 B、酚酞试液 C、硝酸银溶液 D、氯化钡溶液25. 反应:Al2O3+N2+3C 2AlN+3CO,下列有关该反应叙述正确的是( )A、上述反应中,N2是还原剂,Al2O3是氧化剂 B、AlN的摩尔质量为41 g C、AlN中氮元素的化合价为+3 D、上述反应中,每生成1 mol AlN需转移3 mol电子26. 下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( )A、在空气中敞口久置的浓硫酸,溶液质量增大(难挥发性) B、在加热条件下铜与浓硫酸反应(强氧化性、酸性) C、蔗糖与浓硫酸反应中有海绵状的炭生成(吸水性) D、浓硫酸与少量胆矾晶体混合,晶体由蓝色变成白色(脱水性)27. 向混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列对溶液中溶质组成成分判断正确的是( )
A、实验Ⅰ:制备金属钠 B、实验Ⅱ:制取氢氧化亚铁并观察其颜色 C、实验Ⅲ:制取少量的氢氧化铝 D、实验Ⅳ:比较两种物质的热稳定性23. 设NA为阿伏加德罗常数,下列叙述中正确的是( )A、足量铁在氯气中反应,1mol铁失去的电子数为2 NA B、标准状况下22.4 L H2中含中子数为2 NA C、1 L Imol/L的盐酸溶液中,所含氯化氢分子数为NA D、常温下46 g NO2和N2O4混合气体中含有原子数为3NA24. 在自来水的生产中,常通入适量氯气进行杀菌消毒,氯气与水反应的产物之一是盐酸.市场上有些不法商贩为牟取暴利,利用自来水冒充纯净水桶装出售,为辨别真伪,可用以鉴别的一种试剂是( )A、氢氧化钠溶液 B、酚酞试液 C、硝酸银溶液 D、氯化钡溶液25. 反应:Al2O3+N2+3C 2AlN+3CO,下列有关该反应叙述正确的是( )A、上述反应中,N2是还原剂,Al2O3是氧化剂 B、AlN的摩尔质量为41 g C、AlN中氮元素的化合价为+3 D、上述反应中,每生成1 mol AlN需转移3 mol电子26. 下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( )A、在空气中敞口久置的浓硫酸,溶液质量增大(难挥发性) B、在加热条件下铜与浓硫酸反应(强氧化性、酸性) C、蔗糖与浓硫酸反应中有海绵状的炭生成(吸水性) D、浓硫酸与少量胆矾晶体混合,晶体由蓝色变成白色(脱水性)27. 向混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列对溶液中溶质组成成分判断正确的是( )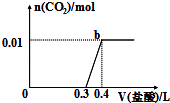 A、原溶液中溶质为Na2CO3和NaHCO3 B、原溶液中溶质为 NaOH和Na2CO3 C、原溶液中溶质为Na2CO3 D、原溶液中溶质为NaHCO328. 体积比为1:2:3所组成的N2、O2和CO2混合气体100g在标准状况下体积为( )A、60 L B、30 L C、11.2 L D、112 L29. 已知K2Cr2O7溶液中存在如下平衡:Cr2O72﹣(橙色)+H2O⇌2H++2CrO42﹣(黄色).
A、原溶液中溶质为Na2CO3和NaHCO3 B、原溶液中溶质为 NaOH和Na2CO3 C、原溶液中溶质为Na2CO3 D、原溶液中溶质为NaHCO328. 体积比为1:2:3所组成的N2、O2和CO2混合气体100g在标准状况下体积为( )A、60 L B、30 L C、11.2 L D、112 L29. 已知K2Cr2O7溶液中存在如下平衡:Cr2O72﹣(橙色)+H2O⇌2H++2CrO42﹣(黄色).①向2mL 0.1mol•L﹣1 K2Cr2O7溶液中滴入3滴6mol•L﹣1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4 , 溶液由黄色变为橙色;
②向酸化K2Cr2O7溶液中滴入适量Na2SO3溶液,溶液由橙色变为绿色:
Cr2O72﹣+8H++3SO32﹣═2Cr3+(绿色)+3SO42﹣+4H2O.下列分析正确的是( )
A、CrO42﹣和S2﹣在酸性溶液中可大量共存 B、实验②说明氧化性:Cr2O72﹣>SO42﹣ C、稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 D、实验①和②均能证明K2Cr2O7溶液中存在上述平衡30. 24mL浓度为0.05mol・L﹣1的Na2SO3溶液,恰好与20mL浓度为0.02mol・L﹣1的K2Cr2O7溶液完全反应,已知Na2SO3能被K2Cr2O7氧化为Na2SO4 , 则元素Cr在还原产物中的化合价为( )A、+2 B、+3 C、+4 D、+5二、填空题
-
31. A、B、C、D、E、F、G、H八种物质间存在着如下图所示的变化关系,其中A、B为单质,相对分子质量A大于B;E在通常状况下为有颜色,有刺激性气味的气体;H为一种氯化物,与碱石灰共热可制取C;G中含A元素35%.
完成下列问题:
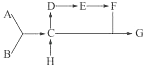 (1)、用化学式表示各物质 .(2)、写出C→D的化学方程式,并标出电子转移方向和数目 .32. 在浓硝酸中放入铜片:
(1)、用化学式表示各物质 .(2)、写出C→D的化学方程式,并标出电子转移方向和数目 .32. 在浓硝酸中放入铜片:①开始反应的化学方程式为 .
②若铜有剩余,则反应将要结束时的反应的离子方程是:
③待反应停止后,再加入少量的25%的稀硫酸,这时铜片上又有气泡产生,其原因是 .
33. 下列有机物有多个官能团:A.
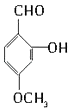
B.
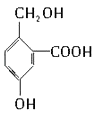
C.

D.
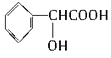
E.CH2=CHCOOCH=CHCOOCH=CH2
(1)、可以看作醇类的是(填入编号) .(2)、可以看作酚类的是 .(3)、可以看作羧酸类的是 .(4)、可以看作酯类的是 .34. 有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:阳离子
K+ Na+ Cu2+Al3+
阴离子
SO42﹣HCO3﹣NO3﹣ OH﹣
为了鉴别上述化合物.分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)、写出B、D的化学式:B , D .(2)、将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为 .(3)、在A溶液中加入少量澄清石灰水,其离子方程式为 .(4)、C常用作净水剂,用离子方程式表示其净水原理 .