2019年初中化学中考难点专题 02 离子共存
试卷更新日期:2019-03-06 类型:二轮复习
一、单选题
-
1. 下列离子能大量共存的是( )A、Cu2+、Na+、OH-、SO42- B、Ba2+、H+、Cl-、SO42- C、K+、Ag+、NO3-、Cl- D、H+、Na+、SO42-、NO3-2. 下列各组离子在pH=2的溶液中能大量共存的是( )A、Na+、Ca2+、Cl﹣、OH﹣ B、K+、Mg2+、NO3-、SO42- C、K+、Ba2+、NO3-、SO42- D、NH4+、Na+、CO32-、Cl﹣3. 在溶液中能大量共存且呈无色的离子组是( )A、Na+、Fe3+、NO3﹣、Cl﹣ B、Ba2+、NH4+、SO42﹣、OH﹣ C、Ag+、H+、Cl﹣、NO3﹣ D、H+、Na+、NO3﹣、SO42﹣4. 在含有大量Na+、OH﹣、SO42﹣的溶液中,还可能大量存在的是( )A、NH4+ B、Ba2+ C、Cu2+ D、K+5. 某校化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH随滴加液体体积变化的曲线如右图所示。下列说法错误的是( )
 A、图中b点所示溶液中,溶质是NaCl B、向图中c点所示溶液中滴加无色酚酞,溶液不变色 C、该实验是将氢氧化钠溶液逐滴滴入到盛有稀盐酸的烧杯中 D、由a点到b点的pH变化过程证明酸和碱发生了中和反应6. 下列各组溶液中,在混合时酸都是过量的,反应完全后,无沉淀生成的是( )A、Ca(OH)2、Na2CO3、HCl B、AgNO3、FeCl3、HNO3 C、BaCl2、K2CO3、H2SO4 D、BaCl2、KOH、H2SO47. 下列各组离子能在指定溶液中大量共存的是:( )A、在稀盐酸中:Na+ CO32- SO42- B、在氯化钠溶液中:NO3- Ca2+ K+ C、在氢氧化钠溶液中:H+ Cu2+ Cl- D、在硫酸铜溶液中:Na+ Ba2+ Cl-8. 下列各组物质在水溶液中能够大量共存,且加入紫色石蕊试液后显红色的是( )A、NaCl Ba(NO3)2 HCl B、NaOH CuSO4 H2SO4 C、NH4NO3 NaOH K2SO4 D、NaNO3 Na2SO4 NH3·H2O9. 能在同一溶液中大量共存,且溶液为无色透明的一组物质是( )
A、图中b点所示溶液中,溶质是NaCl B、向图中c点所示溶液中滴加无色酚酞,溶液不变色 C、该实验是将氢氧化钠溶液逐滴滴入到盛有稀盐酸的烧杯中 D、由a点到b点的pH变化过程证明酸和碱发生了中和反应6. 下列各组溶液中,在混合时酸都是过量的,反应完全后,无沉淀生成的是( )A、Ca(OH)2、Na2CO3、HCl B、AgNO3、FeCl3、HNO3 C、BaCl2、K2CO3、H2SO4 D、BaCl2、KOH、H2SO47. 下列各组离子能在指定溶液中大量共存的是:( )A、在稀盐酸中:Na+ CO32- SO42- B、在氯化钠溶液中:NO3- Ca2+ K+ C、在氢氧化钠溶液中:H+ Cu2+ Cl- D、在硫酸铜溶液中:Na+ Ba2+ Cl-8. 下列各组物质在水溶液中能够大量共存,且加入紫色石蕊试液后显红色的是( )A、NaCl Ba(NO3)2 HCl B、NaOH CuSO4 H2SO4 C、NH4NO3 NaOH K2SO4 D、NaNO3 Na2SO4 NH3·H2O9. 能在同一溶液中大量共存,且溶液为无色透明的一组物质是( )
A、FeCl3 , CuSO4 , NaCl B、BaCl2、Na2SO4、NaOH C、CaCl2、NaNO3、AgNO3 D、K2SO4、NaNO3、NH4Cl10. 一澄清透明溶液,可能含有H+、Na+、Ba2+、Fe3+、Cl﹣、OH﹣和SO 离子的一种或几种.为确定溶液中可能存在的离子,进行下面实验:①经测定,溶液的pH=1;
②取部分样品溶液滴加NaOH溶液,有沉淀生成.继续滴加NaOH溶液至不再产生沉淀为止,过滤;
③向实验②得到的滤液中滴加Na2CO3溶液,又观察到沉淀生成.
分析实验得出的以下结论中,正确的是( )
A、溶液中一定含有H+、Ba2+、Cl﹣ , 一定不含有Na+、Fe3+、OH﹣、SO B、溶液中一定含有H+、Ba2+、Fe3+、Cl﹣ , 一定不含有Na+、OH﹣和SO C、溶液中一定含有H+、Ba2+、Fe3+、Cl﹣ , 一定不含有OH﹣、SO ,可能含有Na+ D、溶液中一定含有H+、Ba2+、Na+、Fe3+ , 一定不含有OH﹣、SO ,可能含有Cl﹣11. 甲乙两工厂的生产污水中各含有下列五种离子中的三种(两厂含有一种相同的离子):H+、Cu2+、K+、NO3﹣、OH﹣ . 若两厂单独排放都会造成严重污染,若将两厂的污水按一定比例混合,沉淀后污水会变成只含有一种溶质的无色澄清溶液,此溶液可做化肥.下列关于污水的分析,正确的是( )
A、K+和OH﹣来自同一工厂 B、Cu2+和K+来自同一工厂 C、OH﹣和Cu2+来自同一工厂 D、H+和K+来自同一工厂12. 下列实验设计或结论合理的是( )A、向某固体滴加稀盐酸,有气泡产生,则该固体一定是碳酸盐 B、除去MgCl2溶液中混有的少量CuCl2 , 可加入适量的Mg(OH)2 , 充分搅拌后过滤 C、CO32﹣、Na+、NO3﹣、K+四种离子可在pH=12的溶液中大量共存 D、将带火星的木条伸入到装有气体的集气瓶中,木条不复燃,证明该气体中不含氧气二、实验探究题
-
13. 某化学兴趣小组在课外活动中对某溶液进行了多次检测,其中三次检测结果如下表所示,请回答:
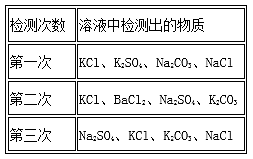 (1)、三次检测结果中第次检测结果错误.(2)、在检测时,为了确定溶液中是否存在硫酸根离子、碳酸根离子和氯离子,先向溶液中加入过量的稀硝酸溶液,检验的离子是;然后继续加入过量的溶液(填化学式),其目的是 ;过滤后,再向滤液中加入溶液(填化学式).14. 某兴趣小组在学习了碱的化学性质后,对氢氧化钙溶液和碳酸钠溶液反应后的废液成分进行了探究。
(1)、三次检测结果中第次检测结果错误.(2)、在检测时,为了确定溶液中是否存在硫酸根离子、碳酸根离子和氯离子,先向溶液中加入过量的稀硝酸溶液,检验的离子是;然后继续加入过量的溶液(填化学式),其目的是 ;过滤后,再向滤液中加入溶液(填化学式).14. 某兴趣小组在学习了碱的化学性质后,对氢氧化钙溶液和碳酸钠溶液反应后的废液成分进行了探究。
(1)、写出反应的化学方程式 , 将废液进行过滤。
(2)、【提出问题】滤液中所含溶质是什么物质。【猜想假设】猜想一:滤液中的溶质是氢氧化钠。
猜想二:滤液中的溶质是氢氧化钠和氢氧化钙。
猜想三:滤液中的溶质是氢氧化钠、氢氧化钙、碳酸钠的混合物。
你的猜想是。
(3)、【实验探究】同学经过讨论认为猜想不成立,理由是。(4)、【设计方案】验证你的猜想:实验步骤
实验现象
实验结论
_
其反应的化学方程式是。
15. 现有某不纯的碳酸钠固体样品,已知其中含有的杂质可能是Na2SO4、CuSO4、NaCl、CaCl2中的一种或几种。为确定其杂质的成分,进行如下实验,出现的现象如图所示(设过程中所有发生的反应都恰好完全进行)。
请你根据实验过程和发生的现象做出分析判断,并填写以下空白:
(1)、把气体D通入紫色石蕊溶液中,观察到的现象是。白色沉淀G的化学式是。(2)、碳酸钠固体样品中一定含有的杂质是(写化学式)。(3)、碳酸钠固体样品中一定不含有的杂质是(写化学式)。(4)、请写出过程②中发生反应的一个化学方程式。(5)、碳酸钠固体样品中还不能确定的物质是(写化学式),要确定它是否存在,可用溶液A再实验。请简述你的设计方案(说明实验操作步骤、发生的现象及结论)。三、综合题
-
16. 化学与环境保护
2015年,我市启动了城郊河道的治理工作,羊亭河是河道治理工作的一个缩影,通过统筹运用截污治污、生态治理等手段,着力打造出了优美的水生态环境。其中一期工程对羊亭河下游2公里河道实施治理
(1)、下面是2014年羊亭河上、中、下游水质监测报告编号
河段
酸碱性(正常值:6.5-8.5)
水质类别
主要污染指标
质量状况
①
上游
7.8
Ⅱ
无
良好
②
中游
6.1
Ⅳ
铜
一般
③
下游
6.3
劣Ⅴ
铜、磷、氮、氨
很差
pH是水质监测的重要指标之一,上述水样酸性最强的是。根据表中的主要污染指标分析污染物的来源可能是、(任答两点)。请列举两条河水被污染的危害: , 。
(2)、在治理过程中,排查发现河道附近有一家化工厂,该化工厂有甲、乙两个车间,排出的废水澄清透明,经分析分别含有三种不同的离子,两厂废水中共有Ba2+、K+、Cu2+、OH-、NO3-、CO32-六种离子。①将甲、乙两车间的废水按适当的比例混合,可以变废为宝,既能使废水中的Ba2+、Cu2+、OH¯、CO32¯等离子转化为沉淀除去,又可用上层清液来浇灌农田,清液中含的溶质主要是(填化学式)。
②经测定甲车间废水的pH=12,则乙车间废水中所含的阴离子是。