2016-2017学年河南省郑州市中牟二中高二上学期开学化学试卷
试卷更新日期:2017-04-21 类型:开学考试
一、选择题
-
1. 将过量SO2通入下列溶液中,能出现白色浑浊的是( )
①Ca(OH)2
②BaCl2
③NaAlO2
④Na2SiO3
⑤Ba(NO3)2
⑥苯酚钠
⑦Na2CO3 .
A、①②④⑦ B、②③⑥⑦ C、④⑤⑥⑦ D、③④⑤⑥2. 用铝粉和四氧化三铁配成铝热剂,分成两等份:一份在高温下恰好完全反应,再与足量稀硫酸反应,生成H2aL,另一份直接与足量的氢氧化钠充分反应,在相同条件下产生H2 bL 则a:b等于( )A、1:1 B、3:4 C、4:3 D、9:83. 一带有活塞的密封容器中盛有A、B组成的混合气体,在通常条件下,从状态I反应到状态II时,气体体积(V)与气体压强(P)的变化曲线如图所示.则反应:A(g)+B(g)=2C(g)( )
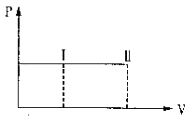 A、是放热反应 B、反应后气体总分子数增多 C、是吸热反应 D、反应物具有的总能量等于生成物具有的总能量4. 下列说法不正确的是( )A、正常雨水的pH为7.0,酸雨的pH小于7.0 B、严格执行机动车尾气排放标准有利于防止大气污染 C、使用二氧化硫和某些含硫化合物漂白食品会对人体健康产生危害 D、使用氯气对自来水消毒过程中,生成的有机氯化物可能对人体有害5. 下列中草药煎制步骤中,属于过滤操作的是( )
A、是放热反应 B、反应后气体总分子数增多 C、是吸热反应 D、反应物具有的总能量等于生成物具有的总能量4. 下列说法不正确的是( )A、正常雨水的pH为7.0,酸雨的pH小于7.0 B、严格执行机动车尾气排放标准有利于防止大气污染 C、使用二氧化硫和某些含硫化合物漂白食品会对人体健康产生危害 D、使用氯气对自来水消毒过程中,生成的有机氯化物可能对人体有害5. 下列中草药煎制步骤中,属于过滤操作的是( )A.冷水浸泡
B.加热煎制
C.箅渣取液
D.灌装保存

 A、A B、B C、C D、D6. 下列物质的水溶液能导电,但属于非电解质的是( )A、CH3COOH B、SO2 C、(NH4)2CO3 D、Cl27. 下列制取硫酸铜的实验设计中,能体现“经济、高效、环保”精神的最佳方案是( )A、铜与浓硫酸共热 B、用铜片为阳极,石墨为阴极,电解稀硫酸 C、先灼烧废铜屑生成氧化铜,然后再用浓硫酸溶解 D、适当温度下,使铜片在持续通入空气的稀硫酸中溶解8. 一定温度下,在容积为2L的密闭容器中发生反应CO(g)+H2O(g)⇌CO2(g)+H2(g),部分数据见表(表中t2>t1),说法错误的是( )
A、A B、B C、C D、D6. 下列物质的水溶液能导电,但属于非电解质的是( )A、CH3COOH B、SO2 C、(NH4)2CO3 D、Cl27. 下列制取硫酸铜的实验设计中,能体现“经济、高效、环保”精神的最佳方案是( )A、铜与浓硫酸共热 B、用铜片为阳极,石墨为阴极,电解稀硫酸 C、先灼烧废铜屑生成氧化铜,然后再用浓硫酸溶解 D、适当温度下,使铜片在持续通入空气的稀硫酸中溶解8. 一定温度下,在容积为2L的密闭容器中发生反应CO(g)+H2O(g)⇌CO2(g)+H2(g),部分数据见表(表中t2>t1),说法错误的是( )反应时间/min
n(CO)/mol
n(H2O)/mol
n(CO2)/mol
n(H2)/mol
0
1.20
0.60
0
0
t1
0.80
t2
0.20
A、反应在t1min末的速率为v(H2)=0.2/t mol•L﹣1•min﹣1 B、平衡时水蒸气的转化率为66.67% C、该温度下反应的平衡常数为1 D、其他条件不变,若起始时,n(CO)=0.60 mol,n(H2O)=1.20 mol,则平衡时水蒸气的转化率为33.33%9. 下列有关金属及化合物的说法正确的是( )A、地壳中含量最多的元素是铝元素 B、在自然界中铝以化合态存在 C、NaCl的焰色反应呈紫色 D、白色絮状沉淀Fe(OH)2可溶于NaOH溶液中10. 已知四种短周期元素的离子:aA2+、bB+、cC3﹣、dD﹣都具有相同电子层结构,则下列叙述不正确的是( )A、原子半径 B>A>C>D B、最高价氧化物水化物的碱性B>A C、离子半径 C3﹣>D﹣>B+>A2+ D、氢化物的稳定性 C>D11. 设NA为阿伏加德罗常数的值,下列叙述正确的是( )A、标准状况下,22.4 L H2O含有分子数为NA B、分子总数为NA的N2、CO混合气体体积约为22.4 L,质量为28 g C、常温常压下,1.6 g CH4含原子数为0.5NA D、足量的CO2与39 g Na2O2发生反应,转移的电子数为NA12. 下列关于有机化合物的说法正确的是( )A、塑料、天然橡胶都是高分子化合物 B、乙烯、聚乙烯和苯分子中均含有碳碳双键 C、棉花、羊毛、蚕丝均属于天然纤维素 D、乙酸和乙醇可用Na2CO3溶液加以区别13. 如图是NaCl、MgSO4的溶解度曲线.下列说法正确的是( )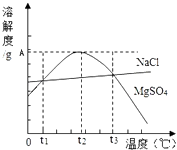 A、只有在t1℃时,NaCl和MgSO4的溶解度才相等 B、t1℃~t2℃,MgSO4的溶解度随温度升高而减小 C、在t2℃时,MgSO4饱和溶液的溶质质量分数最大 D、把MgSO4饱和溶液的温度从t3℃降至t2℃时,有晶体析出14. 下列各组在溶液中进行的两个反应,可用同一离子方程式表示的是( )A、CaCO3和HCl;Na2CO3和HCl B、BaCl2 和H2SO4;Ba(OH)2和H2SO4 C、HCl 和Na2CO3;HCl和NaHCO3 D、KOH 和H2SO4;Ba(OH)2和HNO3
A、只有在t1℃时,NaCl和MgSO4的溶解度才相等 B、t1℃~t2℃,MgSO4的溶解度随温度升高而减小 C、在t2℃时,MgSO4饱和溶液的溶质质量分数最大 D、把MgSO4饱和溶液的温度从t3℃降至t2℃时,有晶体析出14. 下列各组在溶液中进行的两个反应,可用同一离子方程式表示的是( )A、CaCO3和HCl;Na2CO3和HCl B、BaCl2 和H2SO4;Ba(OH)2和H2SO4 C、HCl 和Na2CO3;HCl和NaHCO3 D、KOH 和H2SO4;Ba(OH)2和HNO3二、非选择题
-
15. 选择下列实验方法分离物质,将分离方法的序号填在横线上:
A.过滤 B.结晶 C.分液 D.蒸馏 E.萃取分液
① 分离水和植物油的混合物;
② 分离饱和氯化钾溶液和沙子的混合物;
③ 从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
④ 分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)的混合物;
⑤ 将碘水中的碘单质与水分离.
16. 某同学在画某种元素的一种单核微粒的结构的示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.(1)、该微粒是中性微粒,这种微粒的符号是(2)、该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,该单质与水反应的化学方程式:(3)、该微粒的还原性很弱,失去2个电子后变成原子,该元素在周期表中的位置为(4)、该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,该单质与水反应的化学方程式 .(5)、该微粒的符号为X3﹣ , 则这种微粒的单质的电子式为 . 17. 下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4 500mL的操作,请按要求填空:
17. 下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4 500mL的操作,请按要求填空:(i)所需浓H2SO4的体积为(用下一小题的仪器量取).
(ii)如果实验室有15mL、20mL、50mL量筒,应选用mL量筒最好.
(iii)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的烧杯里,并不断搅拌.
(iv)将的上述溶液沿玻璃棒注入中,并用50mL蒸馏水洗涤烧杯2~3次,洗涤液要注入上述仪器中,并摇匀.
(v)加水至距刻度线1﹣2cm时,改用加水,使溶液凹液面跟刻度相平.
(vi)用“偏高”“偏低”或“无影响”填空:
①定容时,观察液面俯视:;
②摇匀后,液面低于刻度线,没有再加水:;
③取浓H2SO4时,倒出浓H2SO4后的量筒中还残留少量液体未处理: .
18. 某兴趣小组探究SO2气体还原Fe3+、I2 , 他们使用的药品和装置如下图所示: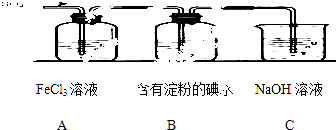 (1)、装置C的作用是 .(2)、若要从FeSO4溶液获得FeSO4•7H2O晶体,必须进行的实验操作步骤:、、过滤、洗涤、自然干燥.(3)、根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生氧化还原反应.
(1)、装置C的作用是 .(2)、若要从FeSO4溶液获得FeSO4•7H2O晶体,必须进行的实验操作步骤:、、过滤、洗涤、自然干燥.(3)、根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生氧化还原反应.①写出SO2与FeCl3溶液反应的离子方程式;
②请写出检验A烧杯中有Fe2+生成的操作方法;
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42﹣ . 该做法(填“合理”或“不合理”),理由是 .
(4)、能表明I﹣的还原性弱于SO2的现象是 .19. 如图是利用废铜屑(含杂质)制备胆矾(硫酸铜晶体)的过程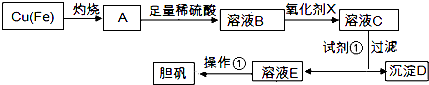
已知:
溶液中被沉淀的离子
Fe3+
Fe2+
Cu2+
完全生成氢氧化物的沉淀时,溶液的pH
≥3.7
≥6.4
≥4.4
请回答:
(1)、下列物质中最适宜做氧化剂X的是 (填字母).A、NaClO B、H2O2 C、KMnO4(2)、加入试剂①是为了调节pH,试剂①可以选择(填化学式).(3)、操作①的名称是 .(4)、沉淀D加入盐酸可以得到FeCl3溶液,关于FeCl3溶液的性质中说法不正确的是 .A、将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应 B、向FeCl3溶液滴加NaOH溶液,出现红褐色沉淀 C、将FeCl3溶液滴加NaOH溶液,将沉淀干燥灼烧,得到Fe(OH)3固体 D、向FeCl3溶液中滴加KSCN溶液,溶液变为红色(5)、沉淀D加入盐酸和铁粉,可以制得FeCl2溶液,实验室保存FeCl2溶液,需加入过量的铁粉防止FeCl2溶液变质,其原因是(用离子方程式表示).20. 把0.8mol X 气体和0.4mol Y 气体混合于2L 密闭容器中,使它们发生如下反应:2X(g)+Y (g)⇌n Z (g)+2W (g).2min 末已生成0.2mol W,若测知以Z的浓度变化表示的反应速率为0.05mol•(L•min)﹣1 , 计算:(1)、前2min内用X的浓度变化表示的平均反应速率;(2)、2min末时Y的浓度.(3)、化学反应方程式中n 值是多少?21. 表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:主族
周期
IA
IIA
IIIA
IVA
VA
VIA
VIIA
0
二
①
②
三
③
④
⑤
⑥
⑦
⑧
四
⑨
⑩
(1)、在③~⑦元素中,原子半径最大的是 , 其离子的原子结构示意图为(2)、写出⑤和⑨最高价氧化物对应水化物间发生反应的离子方程式: .(3)、按要求写出下列两种物质的电子式:①的单质;⑨的过氧化物;(4)、在⑦与⑩的单质中,化学性质较活泼的是 , 可用什么化学反应说明该事实(写出反应的化学方程式): .(5)、请用电子式表示④和⑩组成的化合物的形成过程 .22. 现有常见金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H.其中B是地壳中含量最多的金属.它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出).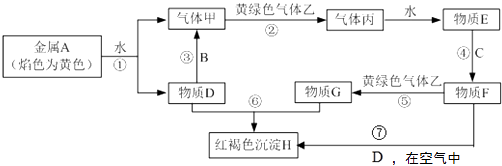 (1)、写出化学式:B , G(2)、写出离子反应方程式:
(1)、写出化学式:B , G(2)、写出离子反应方程式:③
⑦ .
23. 某待测溶液中可能含有SO42﹣、SO32﹣、CO32﹣、HCO3﹣、NO3﹣、Cl﹣、Br﹣中的若干种及一种常见金属阳离子(Mn+),现进行如下实验(每次实验所用试剂均是足量的,鉴定中某些成分可能没有给出).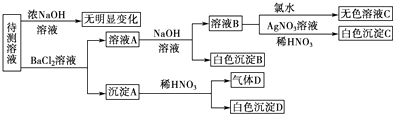
请回答下列问题:
(1)、根据上述框图信息填写下表(不能确定的不填):肯定存在的离子
肯定没有的离子
化学式或离子符号
(2)、出沉淀A三种可能的情况: , 若气体D遇空气变红棕色,则生成沉淀D时肯定发生的反应的离子方程式为 .(3)、若Mn+位于第三周期,则要确定它具体是何种离子的方法是 .