华师大版科学七年级下学期 1.4 配制溶液 (第2课时) 同步练习
试卷更新日期:2019-03-04 类型:同步测试
一、基础达标
-
1. 配制溶质质量分数一定的氯化钠溶液涉及的操作有:①称量 ②溶解 ③计算,其正确的操作顺序为( )A、②①③ B、②③① C、③①② D、③②①2. 用氯化钠配制100g溶质质量分数为20%的氯化钠溶液,现有下列操作:①溶解;②称取氯化钠;③过滤;④量取水;⑤计算;⑥蒸发结晶。正确的操作顺序是( )
A、①②③④ B、⑤②④① C、①③⑤②④① D、①③⑥⑤②④①3. 制作“叶脉书签”需要配制100g12%的NaOH溶液(设水的密度为1g/mL)。下列操作正确的是( )A、称量前调节天平平衡时发现指针向右偏转,可调节游码 B、在左右托盘上垫滤纸称取12.0gNaOH固体 C、将准确称取的NaOH固体直接倒入装有水的量筒中溶解 D、选用100mL量筒量取88.0mL的水4. 下列条件中的氢氧化钙溶液,质量分数最大的是( )A、30℃的不饱和溶液 B、30℃的饱和溶液 C、90℃的不饱和溶液 D、90℃的饱和溶液5. 某同学用25℃的水溶解一定量的NaCl,充分搅拌后发现杯底还有部分NaCl晶体没有溶解.然后该同学又用酒精灯加热至60℃,固体全部溶解.那么在加热前后,以下各量没有发生改变的是( )A、NaCl的溶解度 B、溶质的质量 C、溶剂的质量 D、溶质的质量分数6. 向m g硝酸钾的不饱和溶液中加入硝酸钾晶体,在此变化过程中溶液里溶质的质量分数p%与加入硝酸钾晶体的质量m′的关系正确的是( )A、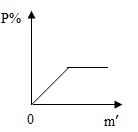 B、
B、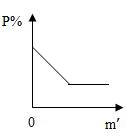 C、
C、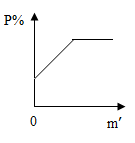 D、
D、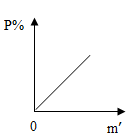 7. 用60%浓硫酸A与20%稀硫酸B来配制30%硫酸溶液,所用溶液A、B的质量比为( )A、2:1 B、1:2 C、3:1 D、1:3
7. 用60%浓硫酸A与20%稀硫酸B来配制30%硫酸溶液,所用溶液A、B的质量比为( )A、2:1 B、1:2 C、3:1 D、1:3二、综合提升
-
8. 实验室欲配制1000 g溶质质量分数为4%的氯化钠溶液。配制步骤为:(1)、计算:需氯化钠固体g,水mL(水的密度是1 g/cm3)。(2)、称量:在称取氯化钠时,左边托盘放 , 右边托盘放 , 二者不能颠倒,在量取水时应注意视线要与保持水平。(3)、溶解:在此过程中玻璃棒的作用:。(4)、贮存:将配好的溶液装入试剂瓶,请你填好标签。9. 在农业上,常需要用质量分数为16%的氯化钠溶液来选种.现需要配制200kg这种溶液,需要氯化钠的质量kg,水的质量是kg.10. 下表是硫酸溶液和氨水的密度与其溶质的质量分数对照表(20℃).
溶液中溶质的质量分数
4%
12%
16%
24%
28%
硫酸溶液的密度/g•mL﹣1
1.02
1.08
1.11
1.17
1.20
氨水的密度/g•mL﹣1
0.98
0.95
0.94
0.91
0.90
请你仔细分析后回答下列问题:
(1)、20℃时,随着溶液中溶质的质量分数逐渐增大,它们的密度变化情况:对于硫酸溶液:;对于氨水: .(2)、向100g 24%的氨水中加入100g水,摇匀,溶液的体积为mL.(3)、向质量分数为24%的硫酸中加入等体积的水,所得溶液中溶质质量分数12%;向质量分数为24%的氨水中加入等体积的水,所得溶液中溶质质量分数12%(用“>”“<”或“=”填空),根据以上计算或推理的结果,总结出的规律是11. 小刚同学在做一定溶质质量分数的氯化钠溶液的配制实验时,其配制过程如图所示。试回答下列问题:
 (1)、写出图中有标号仪器的名称:a , b。(2)、图示实验中有一处明显的错误的是;图示实验中玻璃棒的作用是。(3)、小刚同学要配制90 g质量分数为10%的氯化钠溶液,应称取氯化钠的质量为g,需要量取水的体积为mL(水的密度近似看作1 g/cm3)。(4)、称量氯化钠时,若将氯化钠放在天平的右盘中,砝码放在天平的左盘中,并且在称量过程中使用了游码,则会使称取的质量(填“大于”或“小于”)配制溶液所需的质量。在量取水的体积时,小刚同学俯视读数,则所配制溶液中氯化钠的质量分数(填“偏大”“偏小”或“不变”)。
(1)、写出图中有标号仪器的名称:a , b。(2)、图示实验中有一处明显的错误的是;图示实验中玻璃棒的作用是。(3)、小刚同学要配制90 g质量分数为10%的氯化钠溶液,应称取氯化钠的质量为g,需要量取水的体积为mL(水的密度近似看作1 g/cm3)。(4)、称量氯化钠时,若将氯化钠放在天平的右盘中,砝码放在天平的左盘中,并且在称量过程中使用了游码,则会使称取的质量(填“大于”或“小于”)配制溶液所需的质量。在量取水的体积时,小刚同学俯视读数,则所配制溶液中氯化钠的质量分数(填“偏大”“偏小”或“不变”)。