备考2019年高考化学二轮专题 08 化学反应速率与化学平衡
试卷更新日期:2019-03-01 类型:二轮复习
一、单选题
-
1. 合成氨生产中,说法正确的是( )A、使用催化剂,提高原料的利用率 B、采用高温、高压工艺提高氨的产率 C、产物用水吸收,剩余气体循环利用 D、增大反应物浓度,对v正影响更大2. 加热N2O5 , 依次发生分解反应:①N2O5(g)
 N2O3(g)+O2(g)、②N2O3(g)
N2O3(g)+O2(g)、②N2O3(g)  N2O(g)+O2(g)。在体积为2 L的恒容密闭容器中充入8 mol N2O5 , 加热到T ℃时反应达到平衡状态,此时O2和N2O3的物质的量分别为9 mol、3.4 mol,则T ℃时反应①的平衡常数为( ) A、10.7 B、8.5 C、9.6 D、10.23. 在体积恒定的密闭容器中发生反应N2O4(g)
N2O(g)+O2(g)。在体积为2 L的恒容密闭容器中充入8 mol N2O5 , 加热到T ℃时反应达到平衡状态,此时O2和N2O3的物质的量分别为9 mol、3.4 mol,则T ℃时反应①的平衡常数为( ) A、10.7 B、8.5 C、9.6 D、10.23. 在体积恒定的密闭容器中发生反应N2O4(g) 2NO2(g) ΔH>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( )
2NO2(g) ΔH>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( )  A、A,C两点的反应速率:A>C B、A,C两点气体的颜色:A浅,C深 C、由状态B到状态A,可以用加热的方法 D、A,C两点气体的平均相对分子质量:A>C4. 反应X(g)+Y(g)
A、A,C两点的反应速率:A>C B、A,C两点气体的颜色:A浅,C深 C、由状态B到状态A,可以用加热的方法 D、A,C两点气体的平均相对分子质量:A>C4. 反应X(g)+Y(g) 2Z(g) ΔH<0,达到平衡时,下列说法正确的是( ) A、减小容器体积,平衡向右移动 B、加入催化剂,Z的平衡产率增大 C、增大c(X),X的转化率增大 D、降低温度,Y的平衡转化率增大5. 在恒温恒容的容器中进行反应N2(g)+3H2(g)
2Z(g) ΔH<0,达到平衡时,下列说法正确的是( ) A、减小容器体积,平衡向右移动 B、加入催化剂,Z的平衡产率增大 C、增大c(X),X的转化率增大 D、降低温度,Y的平衡转化率增大5. 在恒温恒容的容器中进行反应N2(g)+3H2(g) 2NH3(g),若氮气浓度由0.1 mol·L-1降到0.06 mol·L-1需2 s,那么由0.06 mol·L-1降到0.024 mol·L-1需要的反应时间为 ( ) A、等于1.8 s B、等于1.2 s C、大于1.8 s D、小于1.8 s6. 可逆反应aA(g)+bB(g)
2NH3(g),若氮气浓度由0.1 mol·L-1降到0.06 mol·L-1需2 s,那么由0.06 mol·L-1降到0.024 mol·L-1需要的反应时间为 ( ) A、等于1.8 s B、等于1.2 s C、大于1.8 s D、小于1.8 s6. 可逆反应aA(g)+bB(g) cC(g)+dD(g) ΔH , 同时符合下列两图中各曲线的是( )
cC(g)+dD(g) ΔH , 同时符合下列两图中各曲线的是( )  A、a+b>c+d T1>T2 ΔH>0 B、a+b>c+d T1<T2 ΔH<0 C、a+b<c+d T1>T2 ΔH>0 D、a+b<c+d T1<T2 ΔH<07. 在一定条件下,对于反应mA(g)+nB(g) cC(g)+dD(g),C物质的浓度(C%)与温度、压强的关系如图所示,下列判断正确的是( )
A、a+b>c+d T1>T2 ΔH>0 B、a+b>c+d T1<T2 ΔH<0 C、a+b<c+d T1>T2 ΔH>0 D、a+b<c+d T1<T2 ΔH<07. 在一定条件下,对于反应mA(g)+nB(g) cC(g)+dD(g),C物质的浓度(C%)与温度、压强的关系如图所示,下列判断正确的是( ) A、ΔH<0 ΔS>0 B、ΔH>0 ΔS<0 C、ΔH>0 ΔS>0 D、ΔH<0 ΔS<08. 80 ℃时,2 L 密闭容器中充入0.40 mol N2O4 , 发生反应N2O4 2NO2 △H=+Q kJ·mol-1(Q>0),获得如下数据:
A、ΔH<0 ΔS>0 B、ΔH>0 ΔS<0 C、ΔH>0 ΔS>0 D、ΔH<0 ΔS<08. 80 ℃时,2 L 密闭容器中充入0.40 mol N2O4 , 发生反应N2O4 2NO2 △H=+Q kJ·mol-1(Q>0),获得如下数据:时间/s
0
20
40
60
80
100
c(NO2)/mol·L-1
0.00
0.12
0.20
0.26
0.30
0.30
下列判断正确的是( )
A、升高温度该反应的平衡常数K减小 B、20~40 s 内,v(N2O4)=0.004 mol·L-1·s1 C、反应达平衡时,吸收的热量为0.30Q kJ D、100s 时再通入0.40 mol N2O4 , 达新平衡时N2O4的转化率增大9. 在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( ) A、图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响 B、图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响 C、图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高 D、图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高10. 在一定条件下,向容积固定的密闭容器中加入1 mol/L N2和5 mol/L H2 , 发生反应:N2+3H2 2NH3 , 2 min时,测得剩余的N2为0.5 mol/L,则下列化学反应速率的表达式中正确的是( )A、v(N2)=1 mol·L-1·min-1 B、v(H2)=0.75 mol·L-1·min-1 C、v(NH3)=0.25 mol·L-1·min-1 D、v(N2)=0.5 mol·L-1·min-111. 在C(s)+CO2(g) 2CO(g) 的反应中,既能增大反应速率又能使平衡向正反应方向移动的措施是( )A、增大压强 B、增加碳的量 C、恒温恒容通入CO2 D、恒温恒压充入N212. 某温度下,在2L恒容密闭容器中投入一定量的A、B发生反应:3A(g)+bB(g) cC(g) ∆H=-QkJ·mol-1(Q>0),12s时生成C的物质的量为0.8mol(反应进程如图所示)。下列说法中正确的是( )
A、图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响 B、图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响 C、图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高 D、图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高10. 在一定条件下,向容积固定的密闭容器中加入1 mol/L N2和5 mol/L H2 , 发生反应:N2+3H2 2NH3 , 2 min时,测得剩余的N2为0.5 mol/L,则下列化学反应速率的表达式中正确的是( )A、v(N2)=1 mol·L-1·min-1 B、v(H2)=0.75 mol·L-1·min-1 C、v(NH3)=0.25 mol·L-1·min-1 D、v(N2)=0.5 mol·L-1·min-111. 在C(s)+CO2(g) 2CO(g) 的反应中,既能增大反应速率又能使平衡向正反应方向移动的措施是( )A、增大压强 B、增加碳的量 C、恒温恒容通入CO2 D、恒温恒压充入N212. 某温度下,在2L恒容密闭容器中投入一定量的A、B发生反应:3A(g)+bB(g) cC(g) ∆H=-QkJ·mol-1(Q>0),12s时生成C的物质的量为0.8mol(反应进程如图所示)。下列说法中正确的是( ) A、2s时,A的反应速率为0.15mol·L-1·s-1 B、图中交点时A的消耗速率等于A的生成速率 C、化学计量数之比b ∶c = 1∶2 D、12s内反应放出0.2QkJ热量13. 对于反应:aA(g)+bB(g) cC(g),反应特点与对应的图像说法正确的是平衡体 系中说法正确的是( )
A、2s时,A的反应速率为0.15mol·L-1·s-1 B、图中交点时A的消耗速率等于A的生成速率 C、化学计量数之比b ∶c = 1∶2 D、12s内反应放出0.2QkJ热量13. 对于反应:aA(g)+bB(g) cC(g),反应特点与对应的图像说法正确的是平衡体 系中说法正确的是( ) A、图甲表明:该反应△H<0,若 a+b>c,则 p1>p2 B、图乙表明,该反应 a+b=c,若△H>0,则 T2>T1 C、图丙中,一定是使用了催化剂 D、图丁中,E 点 v(逆)>v(正)14. 下列比较中前者大于后者的是( )
A、图甲表明:该反应△H<0,若 a+b>c,则 p1>p2 B、图乙表明,该反应 a+b=c,若△H>0,则 T2>T1 C、图丙中,一定是使用了催化剂 D、图丁中,E 点 v(逆)>v(正)14. 下列比较中前者大于后者的是( )A
不同情况下速率:
A(g)+3B(g) 2C(g)
v(A)=0.15 mol/(L·min)
v(B)=0.06 mol/(L·s)
B
加水稀释 10 倍后的pH
1 mL pH=1 的 CH3COOH
1 mL pH=1 的 HCl
C
反应热△H
50 mL 0.1 mol/L 的 NaOH 和50 mL 0.1 mol/L 的 HCl
50 mL 0.1 mol/L 的 NaOH 和50 mL 0.1 mol/L CH3COOH
D
反应速率:Zn+2H+ ═ Zn2++H2 ↑
65 g 粗 Zn(含 Cu 等杂质)与 足量 1 mol/L 的 HCl 反应
65 g 纯 Zn 与足量 1mol/L 的 盐酸反应
A、A B、B C、C D、D15. 已知 A(s)+2B(g) 3C(g),下列能作为反应达平衡的判断标志的是( )①恒温、恒容时,气体的质量不再变化
②恒温、恒容时,混合气体的密度不再变化
③恒温恒压时,容器的容积不再变化
④消耗 2 mol B 的同时消耗 2 mol C
⑤恒容绝热时,当温度不再变化
⑥v(B)正=v(C)逆
A、有 3 个 B、有 4 个 C、有 5 个 D、有 2 个16. 在容积不变的密闭容器中有如下反应:2SO2(g)+O2 (g) 2 SO3(g) △H<0。某研究小组进行了当其他条件不变时,改变某一条件对上述反应影响的研究,下列分析正确的是( )
①图Ⅰ研究的是温度对化学平衡的影响,且乙的温度较高
②图Ⅱ研究的是催化剂对反应速率的影响,化学平衡不移动
③图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响
④图Ⅲ研究的是t0时刻增大O2的浓度对反应速率的影响
A、①② B、②③ C、②④ D、③④17. 在恒容密闭容器中,可逆反应C(s)+CO2(g) 2CO(g)达到平衡状态的标志是( )①单位时间内生成n molCO2的同时生成n molC
②单位时间内生成n molCO2 的同时生成2n mol CO
③CO2 、CO的物质的量浓度之比为1: 2的状态
④混合气体的密度不再改变的状态
⑤混合气体的压强不再改变的状态
⑥C的质量不再改变的状态
A、①④⑤⑥ B、②④⑤⑥ C、②③⑤⑥ D、①②③④18. 处于平衡状态的反应:2H2S(g) 2H2(g)+S2(g) ΔH>0,不改变其他条件的情况下正确的是( )A、加入催化剂,反应途径将发生改变,ΔH也将随之改变 B、升高温度,正、逆反应速率都增大,H2S分解率也增大 C、增大压强,平衡向逆反应方向移动,将引起体系温度降低 D、若体系恒容,注入一些H2后达新平衡,H2浓度将减小19. 关于下列过程熵变的判断错误的是( )A、溶解少量食盐于水中,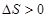 B、纯碳和氧气反应生成
B、纯碳和氧气反应生成 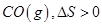 C、H2O(g)变成液态水,
C、H2O(g)变成液态水, 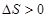 D、CaCO3(s)加热分解为CaO和CO2(g),
D、CaCO3(s)加热分解为CaO和CO2(g), 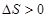 20. 4.0mol PCl3和2.0mol Cl2充入体积不变的密闭容器中,一定条件下发生下述反应:PCl3(g)+Cl2(g) PCl5(g) 达到平衡后,PCl5为0.8 mol,如果此时移走2.0mol PCl3和1.0mol Cl2 , 相同温度下再达到平衡时PCl5的物质的量是( )A、0.8 mol B、小于0.4 mol C、0.4 mol D、大于0.4 mol,小于0.8 mol
20. 4.0mol PCl3和2.0mol Cl2充入体积不变的密闭容器中,一定条件下发生下述反应:PCl3(g)+Cl2(g) PCl5(g) 达到平衡后,PCl5为0.8 mol,如果此时移走2.0mol PCl3和1.0mol Cl2 , 相同温度下再达到平衡时PCl5的物质的量是( )A、0.8 mol B、小于0.4 mol C、0.4 mol D、大于0.4 mol,小于0.8 mol二、填空题
-
21.(1)、在反应A(g)+3B(g)=2C(g)中,若以物质A表示的该反应的化学反应速率为0.2 mol·L-1·min-1 , 则以物质B表示此反应的化学反应速率为 mol·L-1·min-1。(2)、在2 L的密闭容器中,充入2 mol N2和3 mol H2 , 在一定条件下发生反应,3 s后测得N2为1.9 mol,则以H2的浓度变化表示的反应速率为。(3)、将10 mol A和5 mol B放入容积为10 L的密闭容器中,某温度下发生反应:3A(g)+B(g)
 2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L-1·s-1 , 则在2 s时,容器中有 mol A,此时C的物质的量浓度为。
2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L-1·s-1 , 则在2 s时,容器中有 mol A,此时C的物质的量浓度为。
22. 某温度下,在2 L密闭容器中,X、Y、Z三种气态物质发生化学反应时,物质的量随时间变化的关系曲线如图所示: (1)、由图中的数据分析,该反应的化学方程式为。(2)、5 min内用Z表示的平均反应速率为。(3)、化学反应速率受到很多因素的影响,例如:实验室制取氢气时一般用粗锌替代纯锌和稀硫酸反应,这是利用原理加快了氢气生成的速率。23. 一定温度下,在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g)⇌C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的打“√”,否则打“×”
(1)、由图中的数据分析,该反应的化学方程式为。(2)、5 min内用Z表示的平均反应速率为。(3)、化学反应速率受到很多因素的影响,例如:实验室制取氢气时一般用粗锌替代纯锌和稀硫酸反应,这是利用原理加快了氢气生成的速率。23. 一定温度下,在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g)⇌C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的打“√”,否则打“×”①混合气体的密度不发生变化
②容器内气体的压强不发生变化
③混合气体的平均摩尔质量不发生变化
④B的物质的量浓度不发生变化
⑤2VB=VC
⑥生成1molA,同时反应2molB .
24. 在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应:H2(g)+I2(g) 2HI(g) ΔH<0。达到平衡后,改变下列条件,反应速率将如何改变 (填“增大”“减小”或“不变”)?平衡将如何移动(填“向左”“向右”或“不变”)?(1)、升高温度,反应速率将 , 平衡将如何移动;(2)、加入正催化剂,反应速率将 , 平衡将如何移动;(3)、充入更多的H2 , 反应速率将 , 平衡将如何移动;(4)、扩大容器的体积,反应速率将 , 平衡将如何移动;(5)、容器体积不变,通入氖气,反应速率将 , 平衡将如何移动。三、综合题
-
25.(1)、某温度时,在2 L容器中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。

由此分析,该反应的化学方程;
从反应开始至2 min,Z的反应速率为 mol·L-1·min-1。
(2)、若上述反应的△H<0,下列有关该反应速率的叙述,正确的是 。A、升高温度和增大压强均可以增大活化分子百分数,加快反应速率 B、使用催化剂可以使反应的活化能降低,加快反应速率 C、活化分子间所发生的碰撞为有效碰撞 D、降低温度, v正、v逆均减小且v正减小的倍数小于v逆减小的倍数(3)、在一密闭容器中发生反应N2(g)+3H2(g) 2NH3(g) △H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。 t1、t3、t4时刻分别改变的一个条件是:
2NH3(g) △H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。 t1、t3、t4时刻分别改变的一个条件是: 
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氦气
t1时刻;t3时刻;t4时刻(填字母)。
26. 工业上用CO生产燃料甲醇。一定条件下发生反应: (1)、图1是反应时CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)= ;(2)、图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应的焓变是(选填“△H<0”或“ H>0”)反应,写出反应的热化学方程式 ;选择适宜的催化剂,(填“能”或“不能”)改变该反应的反应热;(3)、该反应平衡常数K的表达式为 , 温度升高,平衡常数K (填“增大”、“不变”或“减小”)
(1)、图1是反应时CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)= ;(2)、图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应的焓变是(选填“△H<0”或“ H>0”)反应,写出反应的热化学方程式 ;选择适宜的催化剂,(填“能”或“不能”)改变该反应的反应热;(3)、该反应平衡常数K的表达式为 , 温度升高,平衡常数K (填“增大”、“不变”或“减小”)
27. 工业上利用 CO、CO2、H2 在催化剂作用下合成甲醇。已知在一定温度和压强下:①H2(g)+1/2O2(g) ═ H2O(l) △H1=-285.8 kJ/mol;
②2CO(g)+O2(g) CO2(g) △H2=-566 kJ/mol;
③CH3OH(g)+3/2O2(g) CO2(g)+2H2O(l) △H3=-761.7 kJ/mol。
(1)、CO(g)+2H2(g) CH3OH(g)△H=。(2)、一定温度下,CO(g)+2H2(g) CH3OH(g)在 2 L 的容器中进行反应,充入 n(H2)/n(CO)的值与平衡时反应物的转化率关系如图。
①α 代表(填 H2 或 CO)的转化率。
②若反应开始时,充入 6 mol H2 和 3mol CO,则 A 点平 衡时 K= , p(平)/p(始)=。A 点平衡时再充入CO、H2、CH3OH 各 1 mol,此时 V 正V 逆。(填“>”、“<”、“=”)
(3)、2NO2(g) N2O4(g) △H<0。将一定量的 NO2 气体充入注射器中并密封,拉伸和压缩注射器过程中气体的透光率随时间变化。(气体颜色越深,透光率越小)
①a 点的操作为。
②e 点平衡向移动。
③固定注射器容积,c 点时再充入一定量 N2O4 , 则 NO2 转化率。(填“增大”、“减 小”、“不变”)
28. 反应aA(g)+bB(g) cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示: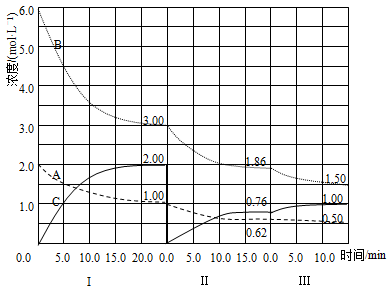
回答问题:
(1)、反应的化学方程式中a∶b∶c为;(2)、A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为;(3)、B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是 , 其值是;(4)、由第一次平衡到第二次平衡,平衡移动的方向是 , 采取的措施是;(5)、比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低;T2T3 (填“<”“>”“=”),判断的理由是。