备考2019年高考化学二轮专题 07 电化学及其应用
试卷更新日期:2019-03-01 类型:二轮复习
一、单选题
-
1. 如图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( )
 A、K1闭合,铁棒上发生的反应为2H++2e- = H2↑ B、K1闭合,石墨棒周围溶液pH逐渐升高 C、K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 D、K2闭合,电路中通过0.002 NA个电子时,两极共产生0.001 mol气体2. 将铜纳米颗粒和银纳米颗粒相隔一定距离固定在石墨片上,然后浸在AgNO3溶液中,可构成一种纳米型原电池。该电池负极发生的反应为( )A、Ag+ + e- =Ag B、Cu - 2e- = Cu2+ C、Cu2+ + 2e- = Cu D、2H+ + 2e- = H2↑3. 下列装置属于原电池装置的是( )A、
A、K1闭合,铁棒上发生的反应为2H++2e- = H2↑ B、K1闭合,石墨棒周围溶液pH逐渐升高 C、K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 D、K2闭合,电路中通过0.002 NA个电子时,两极共产生0.001 mol气体2. 将铜纳米颗粒和银纳米颗粒相隔一定距离固定在石墨片上,然后浸在AgNO3溶液中,可构成一种纳米型原电池。该电池负极发生的反应为( )A、Ag+ + e- =Ag B、Cu - 2e- = Cu2+ C、Cu2+ + 2e- = Cu D、2H+ + 2e- = H2↑3. 下列装置属于原电池装置的是( )A、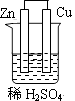 B、
B、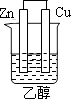 C、
C、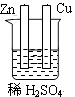 D、
D、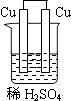 4. NO2、O2和熔融NaNO3可制作燃料电池,其原理如图,下列判断正确的是( )
4. NO2、O2和熔融NaNO3可制作燃料电池,其原理如图,下列判断正确的是( ) A、石墨电极Ⅱ为电池负极 B、电池中NO3-从石墨电极I向石墨电极Ⅱ作定向移动 C、石墨I电极发生的电极反应为NO2+NO3--e-=N2O5 D、每消耗1 mol NO2转移电子2 mol5. 钢铁的外加电流阴极保护法中,铁应( )A、接在电源正极 B、接在电源负极 C、连接锌 D、连接铜6. 铅蓄电池是重要的化学电源之一,其反应为:Pb+PbO2+2H2SO4 PbSO4+2H2O。下列说法中错误的是( )A、充电时阴极为 PbSO4 变为 Pb,发生氧化反应 B、充电时 Pb 与电源负极相连 C、放电时正极增加 64 g,转移 2 mol 电子 D、阳极电极反应为:PbSO4-2e-+2H2O= PbO2+4H++SO42-7. 下列说法错误的是( )A、用惰性电极电解 Na2SO4 溶液,当 2 mol 电子转移时,可加入 18 g 水恢复 B、用惰性电极电解 1 L 1 mol/L CuSO4 溶液,当加入 1 mol Cu(OH)2 恢复电解前浓度时, 电路中转移了 4 mol e- C、用惰性电极电解 1 mol CuSO4 和 1 mol NaCl 的混合溶液,溶液的 pH 先减小后增大 D、要想实现 Cu+H2SO4(稀) ═ CuSO4+H2↑的反应,需在电解池中进行,且 Cu 为阳极8. 圣路易斯大学研制的新型乙醇燃料电池,用能传递质子(H+)的介质作溶剂,反应为C2H5OH+3O2→2CO2+3H2O,如图是该电池的示意图,下列说法正确的是( )
A、石墨电极Ⅱ为电池负极 B、电池中NO3-从石墨电极I向石墨电极Ⅱ作定向移动 C、石墨I电极发生的电极反应为NO2+NO3--e-=N2O5 D、每消耗1 mol NO2转移电子2 mol5. 钢铁的外加电流阴极保护法中,铁应( )A、接在电源正极 B、接在电源负极 C、连接锌 D、连接铜6. 铅蓄电池是重要的化学电源之一,其反应为:Pb+PbO2+2H2SO4 PbSO4+2H2O。下列说法中错误的是( )A、充电时阴极为 PbSO4 变为 Pb,发生氧化反应 B、充电时 Pb 与电源负极相连 C、放电时正极增加 64 g,转移 2 mol 电子 D、阳极电极反应为:PbSO4-2e-+2H2O= PbO2+4H++SO42-7. 下列说法错误的是( )A、用惰性电极电解 Na2SO4 溶液,当 2 mol 电子转移时,可加入 18 g 水恢复 B、用惰性电极电解 1 L 1 mol/L CuSO4 溶液,当加入 1 mol Cu(OH)2 恢复电解前浓度时, 电路中转移了 4 mol e- C、用惰性电极电解 1 mol CuSO4 和 1 mol NaCl 的混合溶液,溶液的 pH 先减小后增大 D、要想实现 Cu+H2SO4(稀) ═ CuSO4+H2↑的反应,需在电解池中进行,且 Cu 为阳极8. 圣路易斯大学研制的新型乙醇燃料电池,用能传递质子(H+)的介质作溶剂,反应为C2H5OH+3O2→2CO2+3H2O,如图是该电池的示意图,下列说法正确的是( ) A、a极为电池的正极 B、电池正极的电极反应为:4H++O2+4e-=2H2O C、电池工作时电流由a极沿导线经灯泡再到b极 D、电池工作时,1mol乙醇被氧化时就有6mol电子转移9. 若要在铜片上镀银时,下列叙述错误的是( )
A、a极为电池的正极 B、电池正极的电极反应为:4H++O2+4e-=2H2O C、电池工作时电流由a极沿导线经灯泡再到b极 D、电池工作时,1mol乙醇被氧化时就有6mol电子转移9. 若要在铜片上镀银时,下列叙述错误的是( )①将铜片接在电源的正极 ②将银片接在电源的正极 ③在铜片上发生的反应是:Ag+ +e-=Ag ④在银片上发生的反应是:4OH- - 4e-=O2 +2H2O ⑤可用硫酸溶液作电解质 ⑥可用硝酸银溶液作电解质
A、①③⑥ B、②③⑥ C、①④⑤ D、②③④⑥10. 如图是一个用铂丝作电极,电解MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色。(指示剂的pH变色范围:6.8—8.0,酸色—红色,碱色—黄色,Mg(OH)2沉淀的pH=9),下列叙述错误的是( ) A、电解过程中电极附近溶液颜色变化是A管溶液由红变黄,B管溶液不变色 B、A管中发生的反应:2H2O+2e-+Mg2+=H2↑+Mg(OH)2↓ C、取出a试管,将带有火星的木条伸入试管内,看到木条复燃 D、电解一段时间后,A管产生白色沉淀,切断电源,将电解液倒入烧杯内,白色沉淀溶解或部分溶解11. pH=a的某电解质溶液中,插入两支惰性电极,通直流电一段时间后,溶液的pH>a,则该电解质可能是( )A、Na2SO4 B、H2SO4 C、AgNO3 D、NaCl12. 模拟电渗析法淡化海水的工作原理示意图如下。已知X、Y均为惰性电极,模拟海水中含Na+、Cl-、Ca2+、Mg2+、SO24-等离子。下列叙述不正确的是( )
A、电解过程中电极附近溶液颜色变化是A管溶液由红变黄,B管溶液不变色 B、A管中发生的反应:2H2O+2e-+Mg2+=H2↑+Mg(OH)2↓ C、取出a试管,将带有火星的木条伸入试管内,看到木条复燃 D、电解一段时间后,A管产生白色沉淀,切断电源,将电解液倒入烧杯内,白色沉淀溶解或部分溶解11. pH=a的某电解质溶液中,插入两支惰性电极,通直流电一段时间后,溶液的pH>a,则该电解质可能是( )A、Na2SO4 B、H2SO4 C、AgNO3 D、NaCl12. 模拟电渗析法淡化海水的工作原理示意图如下。已知X、Y均为惰性电极,模拟海水中含Na+、Cl-、Ca2+、Mg2+、SO24-等离子。下列叙述不正确的是( ) A、N是阴离子交换膜 B、Y电极上产生有色气体 C、X电极区域有浑浊产生 D、X电极反应式为2H2O-4e-=4H++O2↑13. 下列图示中关于铜电极的连接或描述错误的是( )A、
A、N是阴离子交换膜 B、Y电极上产生有色气体 C、X电极区域有浑浊产生 D、X电极反应式为2H2O-4e-=4H++O2↑13. 下列图示中关于铜电极的连接或描述错误的是( )A、 B、
B、 C、
C、 D、
D、 14. 如图所示的电解池Ⅰ和Ⅱ中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b>d。符合上述实验结果的盐溶液是( )
14. 如图所示的电解池Ⅰ和Ⅱ中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b>d。符合上述实验结果的盐溶液是( )
选项
X
Y
A
MgSO4
CuSO4
B
AgNO3
Pb(NO3)2
C
FeSO4
Al2 (SO4)3
D
CuSO4
AgNO3
A、A B、B C、C D、D15. 关于下列装置的说法,正确的是( ) A、装置①中盐桥内的K+移向CuSO4溶液 B、装置①将电能转变为化学能 C、若装置②用于铁棒镀铜,则N极为铁棒 D、若装置②用于电解精炼铜,精炼过程溶液中的Cu2+浓度保持不变16. 如图装置电解一段时间,当某极析出0.32gCu时,I、Ⅱ、Ⅲ中溶液pH分别为(溶液足量,体积均为100mL且电解前后溶液体积变化及气体的溶解忽略不计) ( )
A、装置①中盐桥内的K+移向CuSO4溶液 B、装置①将电能转变为化学能 C、若装置②用于铁棒镀铜,则N极为铁棒 D、若装置②用于电解精炼铜,精炼过程溶液中的Cu2+浓度保持不变16. 如图装置电解一段时间,当某极析出0.32gCu时,I、Ⅱ、Ⅲ中溶液pH分别为(溶液足量,体积均为100mL且电解前后溶液体积变化及气体的溶解忽略不计) ( ) A、13、7、1 B、12、7、2 C、1、7、13 D、7、13、117. 甲醇燃料电池结构示意图如下。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O。下列说法错误的是 ( )
A、13、7、1 B、12、7、2 C、1、7、13 D、7、13、117. 甲醇燃料电池结构示意图如下。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O。下列说法错误的是 ( ) A、右电极为电池正极,左电极为电池负极 B、负极反应式为:CH3OH+H2O-6e-=CO2+6H+ C、b处通入空气,a处通入甲醇 D、正极反应式为:O2+2H2O+4e-=4OH-18. 一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是
A、右电极为电池正极,左电极为电池负极 B、负极反应式为:CH3OH+H2O-6e-=CO2+6H+ C、b处通入空气,a处通入甲醇 D、正极反应式为:O2+2H2O+4e-=4OH-18. 一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是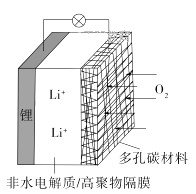 A、放电时,多孔碳材料电极为负极 B、放电时,外电路电子由多孔碳材料电极流向锂电极 C、充电时,电解质溶液中Li+向多孔碳材料区迁移 D、充电时,电池总反应为Li2O2-x=2Li+(1- )O219. 硫酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一,采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:
A、放电时,多孔碳材料电极为负极 B、放电时,外电路电子由多孔碳材料电极流向锂电极 C、充电时,电解质溶液中Li+向多孔碳材料区迁移 D、充电时,电池总反应为Li2O2-x=2Li+(1- )O219. 硫酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一,采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:
下列叙述错误的是( )
A、合理处理废旧电池有利于保护环境和资源再利用 B、从“正极片”中可回收的金属元素有Al、Fe、Li C、“沉淀”反应的金属离子为Fe3+ D、上述流程中可用硫酸钠代替碳酸钠二、填空题
-
20. 与MnO2﹣Zn电池类似,K2FeO4﹣Zn也可以组成碱性电池,其电极反应正极: , 负极: , 该电池总反应的离子方程式为 .21. 写出以石墨作电极电解盐酸的电极反应式:
阳极:
阴极:
总反应: .
22. 原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计如图装置: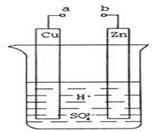
①a和b不连接时,烧杯中现象是。
②a和b用导线连接,Cu极为原电池极(填“正”或“负”),电极反应式为:;溶液中H+移向(填“Cu”或“Zn”)极。电池总反应式为:。
③若电解质溶液改为AgNO3溶液,当转移0.2mol电子时,则理论上Cu片质量变化为g。
23. 利用如图装置,可以模拟铁的电化学防护.若X为铜,为减缓铁的腐蚀,开关K应置于 处.铁棒上发生的电极反应为 , 该种防护方法称为若X为锌棒,开关K置于处,铁棒上的电极反应为该电化学防护法称为 .
 24. Mg﹣H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,其工作原理如图所示.电池总反应是:Mg+H2O2+2H+═Mg2++2H2O
24. Mg﹣H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,其工作原理如图所示.电池总反应是:Mg+H2O2+2H+═Mg2++2H2O①负极材料为 , 发生反应(填氧化或还原)
②两极电极反应式为:负极:正极: .
③有4.8gMg反应时时,外电路中转移电子数为 .

三、综合题
-
25. 金属腐蚀的电化学原理可用下图模拟。
 (1)、请写出有关电极反应式:
(1)、请写出有关电极反应式:①铁棒上的电极反应式:
碳棒上的电极反应式:
(2)、该图所表示的是(填“析氢”或“吸氧”)腐蚀。(3)、若将O2撤走,并将NaCl溶液改为稀H2SO4溶液,则此图可表示(填“析氢”或“吸氧”)腐蚀原理;若用牺牲阳极法来保护铁棒不被腐蚀溶解,即可将碳棒改为棒。26. 如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜(含有少量锌、金、银等杂质)的精炼原理,其中乙装置中X为阳离子交换膜。回答下列问题: (1)、甲烷燃料电池负极的电极反应式为。(2)、乙装置中阳离子通过X膜向 极(填“Fe”或“C”)移动;丙装置中粗铜为电极(填“A”或“B”)(3)、若在标况下,有2.24L氧气参与反应,则乙装置中右侧溶液(填“增加”或“减少”)g; 丙装置中CuSO4浓度(填“增加”、“减少” 或“不变”)。27. 请用所学的化学知识解释下列反应。(1)、Ag2O-Zn-KOH 组成的纽扣电池,正极区 pH 增大,请用电极反应式解释:。(2)、炒过菜的铁锅不及时清洗(未洗净残液中含 NaCl),不久会生锈,写出正极电极反应 式: , 其锈蚀过程属于(填“析氢腐蚀”或“吸氧腐蚀”)。(3)、CuO 中含 Fe2O3 , 要想用此化合物制得纯净的 CuCl2 固体涉及流程为:
(1)、甲烷燃料电池负极的电极反应式为。(2)、乙装置中阳离子通过X膜向 极(填“Fe”或“C”)移动;丙装置中粗铜为电极(填“A”或“B”)(3)、若在标况下,有2.24L氧气参与反应,则乙装置中右侧溶液(填“增加”或“减少”)g; 丙装置中CuSO4浓度(填“增加”、“减少” 或“不变”)。27. 请用所学的化学知识解释下列反应。(1)、Ag2O-Zn-KOH 组成的纽扣电池,正极区 pH 增大,请用电极反应式解释:。(2)、炒过菜的铁锅不及时清洗(未洗净残液中含 NaCl),不久会生锈,写出正极电极反应 式: , 其锈蚀过程属于(填“析氢腐蚀”或“吸氧腐蚀”)。(3)、CuO 中含 Fe2O3 , 要想用此化合物制得纯净的 CuCl2 固体涉及流程为:
Fe(OH)3
Cu(OH)2
开始沉淀 pH
1.9
4.7
完全沉淀 pH
3.2
6.7
①物质 a 为加入把 pH 调到。
②操作 c 为在条件下加热蒸干得固体 CuCl2。
(4)、C2H6在足量 O2中完全燃烧,当转移 7 mol e-时放热 a kJ,写出表示 C2H6 燃烧热的热化学方程式:。(5)、CO2 中混有 HCl,可用饱和 NaHCO3 溶液吸收 HCl,请用平衡移动原理解释原因28. 知识的梳理和感悟是有效学习的方法之一。某学习小组将有关“电解饱和食盐水”的相关内容进行梳理,形成如下问题(显示的电极均为石墨)。(1)、图中,电解一段时间后,气球b中的气体是(填化学式),U形管(填“左”或“右”)边的溶液变红。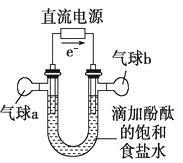 (2)、利用图制作一种环保型消毒液发生器,可制备“84”消毒液的有效成分,则c为电源的极;该发生器中反应的总离子方程式为。
(2)、利用图制作一种环保型消毒液发生器,可制备“84”消毒液的有效成分,则c为电源的极;该发生器中反应的总离子方程式为。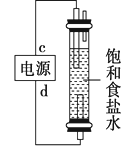 (3)、氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。
(3)、氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。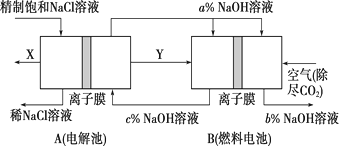
①燃料电池B中的电极反应式分别为
负极: ,
正极:。
②分析图3可知,氢氧化钠的质量分数为a%、b%、c%,由大到小的顺序为。
29. 如图是原电池电解池的组合装置图。请回答: (1)、若甲池某溶液为稀H2SO4 , 闭合K时,电流表指针发生偏转,电极材料A为碳棒B为Fe,则:①A碳电极上发生的现象为。
(1)、若甲池某溶液为稀H2SO4 , 闭合K时,电流表指针发生偏转,电极材料A为碳棒B为Fe,则:①A碳电极上发生的现象为。②丙池中E、F电极均为碳棒,E电极为(填“正极”、“负极”、“阴极”或“阳极”)。如何检验F侧出口的产物。
(2)、若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如上图所示的甲池原电池装置,则B(正极)电极反应式为。(3)、若甲池为氢氧燃料电池,某溶液为KOH溶液,A极通入氢气,①A电极的反应方程式为。
②若线路中转移0.02mol电子,乙池中C极质量变化g。
(4)、若用少量NaOH溶液吸收SO2气体,对产物NaHSO3进一步电解可制得硫酸,将丙池电解原理示意图改为如下图所示。电解时阳极的电极反应式为。