2019年初中化学中考复习 12 金属的化学性质
试卷更新日期:2019-02-28 类型:一轮复习
一、单选题
-
1. 下列图象分别与选项中的操作相对应,其中不合理的是( )A、
 加热氯酸钾与二氧化锰的混合物
B、
加热氯酸钾与二氧化锰的混合物
B、 向等质量的两种金属粉末中,加过量稀硫酸
C、
向等质量的两种金属粉末中,加过量稀硫酸
C、 在密闭容器中混合镁与稀盐酸
D、
在密闭容器中混合镁与稀盐酸
D、 向一定质量的稀硫酸中加入打磨过的铝片
2. 有甲、乙、丙三种金属,如果将甲、乙、丙分别投入到CuSO4溶液中,一段时间后,甲、丙表面出现红色物质,乙没有明显现象;再将大小相同的甲、丙分别放到相同的盐酸中,甲、丙均产生气泡,但甲产生气泡的速度明显快于丙,则甲、乙、丙三种金属的活动性顺序是()A、甲>丙>乙 B、丙>乙>甲 C、甲>乙>丙 D、丙>甲>乙3. 常温下向一定质量的稀盐酸中逐渐加入镁条,充分反应(忽略挥发)。下列图像正确的是()
向一定质量的稀硫酸中加入打磨过的铝片
2. 有甲、乙、丙三种金属,如果将甲、乙、丙分别投入到CuSO4溶液中,一段时间后,甲、丙表面出现红色物质,乙没有明显现象;再将大小相同的甲、丙分别放到相同的盐酸中,甲、丙均产生气泡,但甲产生气泡的速度明显快于丙,则甲、乙、丙三种金属的活动性顺序是()A、甲>丙>乙 B、丙>乙>甲 C、甲>乙>丙 D、丙>甲>乙3. 常温下向一定质量的稀盐酸中逐渐加入镁条,充分反应(忽略挥发)。下列图像正确的是()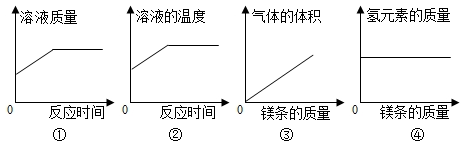
A、①② B、②③ C、①④ D、②④4. 向AgNO3、Cu(NO3)2和Mg(NO3)2的混合溶液中加入一些铁粉,充分反应后过滤。下列说法正确的是( )A、滤纸上一定有Ag和Cu B、滤纸上一定有Ag,可能有Cu、Fe和Mg C、滤液中可能含有Fe2+、Mg2+ D、滤液中一定有Fe2+、Mg2+ , 可能含有Ag+、Cu2+5. 有X,Y,Z三种金属,如果把Z和Y分别放入稀盐酸中,Z溶解并产生氢气,Y不反应;如果把X和Y分别放入硝酸银溶液中,过一会儿,在Y表面有银析出,而X没有变化,根据以上实验事实,判断这三种金属的活动性由强到弱的顺序为( )A、Z、Y、X B、X、Y、Z C、Y、X、Z D、X、Z、Y6. 下列有关实验现象的描述中,正确的是( )A、铜片可以在黄铜片表面刻画出清晰的划痕 B、高温加热氧化铜与木炭的混合粉,红色粉末变黑,同时产生使澄清石灰水变浑浊的气体 C、镁条中滴加稀盐酸后,迅速产生大量气泡,同时试管壁发热 D、铝丝插入少量硫酸铜溶液中,表面有红色物质出现,最终溶液由蓝色变成浅绿色7. 将一定量的锌粉加入 和 的混合溶液中,充分反应后过滤,得到滤渣和滤液。下列关于滤渣和滤液的分析错误的是( )A、 向滤渣中滴加稀盐酸,若无明显现象,则滤液中一定含有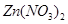 和
和 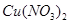 B、向滤渣中滴加稀盐酸,若产生气泡,则滤液中一定没有
B、向滤渣中滴加稀盐酸,若产生气泡,则滤液中一定没有 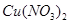 C、向滤液中滴加稀盐酸,若产生白色沉淀,则滤渣中一定没有
C、向滤液中滴加稀盐酸,若产生白色沉淀,则滤渣中一定没有 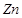 和
和  D、若滤液呈蓝色,则滤渣中一定含有
D、若滤液呈蓝色,则滤渣中一定含有 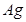 ,可能含有
,可能含有  8. 要验证Zn、Cu、Ag三种金属的活动性顺序,同学们设计了以下四个实验。你认为其中不需要进行的是( )
8. 要验证Zn、Cu、Ag三种金属的活动性顺序,同学们设计了以下四个实验。你认为其中不需要进行的是( )
A、将锌片放入稀硫酸中 B、将铜片放入稀硫酸中 C、将铜片放入硝酸银溶液中 D、将锌片放入硝酸银溶液中9. 现有等质量甲、乙、丙三种金属,分别放入三份浓度相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中化合价均为+2价).则下列说法中不正确的是( )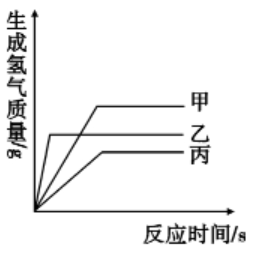 A、生成氢气的质量:甲>乙>丙 B、金属活动性:乙>甲>丙 C、相对原子质量:乙>丙>甲 D、消耗硫酸的质量:甲>乙>内10. 下列说法错误的是( )
A、生成氢气的质量:甲>乙>丙 B、金属活动性:乙>甲>丙 C、相对原子质量:乙>丙>甲 D、消耗硫酸的质量:甲>乙>内10. 下列说法错误的是( ) A、C可能是铜 B、将Fe放在B的盐溶液中可以置换出B C、四种金属的活动性顺序是:A>B>Fe>C D、钢和生铁都是铁合金11. 下列图象能正确反映对应变化关系的是( )
A、C可能是铜 B、将Fe放在B的盐溶液中可以置换出B C、四种金属的活动性顺序是:A>B>Fe>C D、钢和生铁都是铁合金11. 下列图象能正确反映对应变化关系的是( )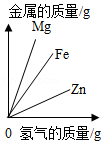
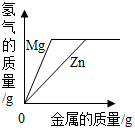
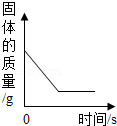
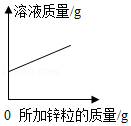
Mg、Zn、Fe与稀盐酸反应
等质量等质量分数的盐酸与足量的镁粉、锌粉
将铜片加入一定量的硝酸银溶液中
向一定质量的氯化锌和盐酸溶液中加入锌粒
A、A B、B C、C D、D二、综合题
-
12. 以下是探究Fe、Cu、Ag三种金属活动性的实验。
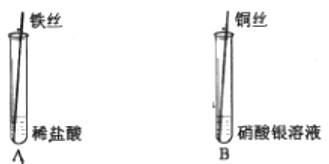
①A中观察到铁丝表面;
②B中发生反应的化学方程式为 , 该实验过程中可观察到的现象有
a.冒气泡
b.出现海绵状银白色固体
c.铜丝表面变黑
d.无色溶液变为蓝色
③为达到实验目的,还需补充一个实验(写成所需试剂化学式)。
13. 金属在生产和生活中有广泛的应用。A.黄金饰品
 B.铝蒸锅
B.铝蒸锅  C.铜导线
C.铜导线  (1)、下列金属制品中,利用金属导电性的是(填字母)。(2)、铁制品在沙漠地区不易锈蚀的原因是:(3)、工业上用一氧化碳和赤铁矿炼铁反应的化学方程式是(4)、某厂排放的废水中含有硫酸铜,将废水处理可得到铜和铁红(氧化铁)两种产品,过程如下图所示(废水中的其他物质不参与反应):
(1)、下列金属制品中,利用金属导电性的是(填字母)。(2)、铁制品在沙漠地区不易锈蚀的原因是:(3)、工业上用一氧化碳和赤铁矿炼铁反应的化学方程式是(4)、某厂排放的废水中含有硫酸铜,将废水处理可得到铜和铁红(氧化铁)两种产品,过程如下图所示(废水中的其他物质不参与反应):
过程①中发生反应的化学方程式是。A~G七种物质中含铁元素的物质有(填字母代号)。
14. 如图是五种初中常见物质之间的转化关系。用“一”表示两种物质之间能发生反应,“→”表示一种物质可以转化为另一种物质,且省略部分反应物或生成物及条件。B和D均为黑色固体,C为紫红色固体,A的溶液中溶质含有三种元素,请回答下列问题: (1)、请写出C和E两种物质的化学式C、E;(2)、请写出D转化C的化学方程式;(3)、请写出B与足量A反应的实验现象。
(1)、请写出C和E两种物质的化学式C、E;(2)、请写出D转化C的化学方程式;(3)、请写出B与足量A反应的实验现象。三、实验探究题
-
15. 某同学为了探究相关金属的性质,做了下列实验:
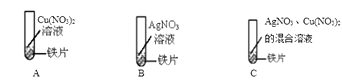
① A 中现象;B 中反应的基本类型是反应。
② 通过 A 和 B 实验不能证明铁、铜、银三种金属的活动性强弱,需补充一个实验达到 实验目的,写出该反应的化学方程式为。
③ 实验 C 中物质充分反应后,猜想试管中溶液的溶质是
Ⅰ. Fe(NO3)2、Cu(NO3)2、AgNO3 Ⅱ. Fe (NO3)2、AgNO3 Ⅲ.Fe (NO3)2、Cu(NO3)2 Ⅳ.。 其中只有一个不合理的猜想是。(填编号)
④ 进行定量实验可确定猜想。
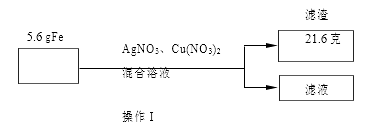
操作Ⅰ是。根据数据分析,③中猜想成立(填编号)。
16. 某化学兴趣小组的学生,发现金属R不在初中学到的金属活动性顺序表中,该小组为了了解R与常见金属铝、铜的金属活动性顺序,进行如下探究活动:(1)、(作出猜想)他们考虑到铝的活动性比铜强,对三种金属的活动性顺序作出如下猜想:猜想一:Al>Cu>R,猜想二:R>Al>Cu,猜想三:。
(2)、(查阅资料)R是一种银白色的金属,RSO4溶液呈蓝色;常温下铝的表面会形成一层致密的氧化膜;硫酸铝、氯化铝、硝酸铝的溶液均为无色。(实验探究)为了探究哪一种猜想成立,甲、乙、丙三位同学分别针对猜想一、猜想二、猜想三设计实验方案并展开实验探究。
猜想
主要操作
主要现象
实验结论
一
打磨R丝,并将其插入到硫酸铜溶液中
R丝表面覆盖了一层红色的物质
猜想一(“成立”或“不成立”)
二
把铝丝插入RSO4溶液中
猜想二成立
三
打磨粗细相同的R丝、铝丝、铜丝,分别将它们插入到体积相同、溶质质量分数也相同的稀硫酸中
①R丝表面产生气泡缓慢,溶液由无色逐渐变成蓝色
②铝丝表面产生气泡较快
③铜丝表面没有气泡产生
猜想三成立
(交流反思)究竟哪种猜想成立?三位同学经讨论交流,发现乙同学在实验前没有打磨铝丝,这可能会导致实验结论错误。于是他们先打磨铝丝,再将其插入到RSO4溶液中,一段时间后,溶液的颜色由色变为色;进而确认猜想二不成立,猜想三成立。写出Al与稀硫酸反应的化学方程式:。
(归纳总结)探究结束后,他们总结得出:通过金属与酸反应或金属与盐溶液反应可以比较金属活动性强弱。
四、计算题
-
17. 某化学兴趣小组同学为回收一块质量为40 g的铜锌合金中的铜,将该合金放入烧杯中,逐渐加入稀硫酸至不再产生气泡时,恰好用去稀硫酸100 g,烧杯内剩余固体27 g。请完成下列计算:(1)、40 g铜锌合金中锌的质量是多少g 。(2)、计算所用稀硫酸中溶质的质量分数为多少。