备考2019年高考化学二轮专题 05 元素周期表和元素周期律
试卷更新日期:2019-02-21 类型:二轮复习
一、单选题
-
1. 某元素原子核外第二层是其他层电子数之和的2倍,则该元素的核电荷数为( )A、4 B、8 C、12 D、162. 短周期元素X、Y、Z在周期表中的位置如图所示,则下列说法中错误的是( )
X
Y
Z
A、X元素的最外层电子数为2 B、Y的气态氢化物的化学式为HY C、Z的最高价氧化物的化学式为ZO2 D、X、Y、Z的单质中X单质最稳定3. W、X、Y、Z是四种短周期主族元素,W和X形成的化合物是汽车尾气成分之一,X和Z是同族元素且两者形成的某种化合物能使品红溶液褪色,W、Y、Z对应的最高价氧化物的水化物两两之间都能发生反应,下列说法中正确的是( )A、W的简单氢化物稳定性比X的简单氢化物稳定性强 B、自然界中都存在W、X、Z元素对应的单质 C、X的简单氢化物沸点比Z简单氢化物低 D、Z可在加热条件下将单质铜氧化至+2价4. 元素R的质量数为A,Rn-的核外电子数为x,则w g Rn-所含中子的物质的量为( )A、(A-x+n)mol B、(A-x-n)mol C、(A-x+n)w/Amol D、(A-x-n)w/Amol5. 已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )A、质子数c>b B、离子的还原性Y2-<Z- C、氢化物的稳定性H2Y>HZ D、原子半径X>W6. 四种短周期元素X、Y、Z、W的原子序数依次增大,X的最外层电子数是次外层电子数2倍,Y、W同主族且能形成两种常见的化合物,Y、W质子数之和是Z质子数的2倍则下列说法中正确的是( )A、X的氢化物的沸点可能高于Y的氢化物的沸点 B、原子半径比较:X<Y<Z<W C、X2H4与H2W都能使溴水褪色,且褪色原理相同 D、短周期所有元素中,Z的最高价氧化物的水化物碱性最强7. W、X、Y、Z均为短周期主族元素,原子序数依次增大。X原子的次外层电子数为a,最外层电子数为b;Y原子的L层电子数为(a+b),M层电子数为(b-a);W、Z原子的最外层电子数分别为(b-1)和b。下列有关说法一定正确的是( )A、气态氢化物的稳定性:X<Y B、氧化物的水化物的酸性:W<Z C、原子半径:W>Z D、X与Y形成的化合物常温下不能与盐酸反应8. 五种主族元素X、Y、Z、M和N在周期表中的位置如图所示。下列说法正确的是( ) A、M的原子半径比N小 B、Y和Z既可形成Z2Y,也可形成Z2Y2 C、X2M的热稳定性比X2Y强 D、M和N的氧化物的水化物均为强酸9. 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,
A、M的原子半径比N小 B、Y和Z既可形成Z2Y,也可形成Z2Y2 C、X2M的热稳定性比X2Y强 D、M和N的氧化物的水化物均为强酸9. 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,
第3周期中Z元素的简单离子半径最小。下列说法正确的是( )
A、Z位于第3周期ⅠA族 B、X、Y、Z、W、Q这五种元素的最高正价均等于其所在族的族序数 C、X的最高价氧化物对应的水化物和X的氢化物形成的化合物属于共价化合物 D、Y元素气态氢化物比W元素的气态氢化物更稳定10. 下列有关物质性质的比较,结论正确的是( )A、溶解度:Na2CO3<NaHCO3 B、热稳定性:HCl<PH3 C、沸点:C2H5SH<C2H5OH D、碱性:LiOH<Be(OH)211. 短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是( )A、原子半径:r(W) > r(Z) > r(Y) B、由X、Y 组成的化合物中均不含共价键 C、Y 的最高价氧化物的水化物的碱性比Z的弱 D、X 的简单气态氢化物的热稳定性比W的强12. 主族元素W、X、Y、Z的原子序数依次增加,且均不大于20,W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的是( )A、常温常压下X的单质为气态 B、Z的氢化物为离子化合物 C、Y和Z形成的化合物的水溶液呈碱性 D、W与Y具有相同的最高化合价13. 短周期元素R、T、Q、W在周期表中的相对位置如图所示,其中Q原子的质子数是其最外层电子数的三倍。下列说法正确的是( )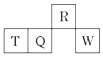 A、原子半径:R>T B、氧化物对应水化物的酸性:W>Q C、最简单气态氢化物的热稳定性:R>Q D、Q与W形成的化合物中,各原子的最外层都满足8电子稳定结构
A、原子半径:R>T B、氧化物对应水化物的酸性:W>Q C、最简单气态氢化物的热稳定性:R>Q D、Q与W形成的化合物中,各原子的最外层都满足8电子稳定结构二、填空题
-
14.
下表为元素周期表的一部分,针对表中①~⑥元素,回答下列问题

(1)①元素在周期表中的位置是第二周期 族.
(2)②和⑤两种元素中原子半径较大的是 (填元素符号).
③和④两种元素的最高价氧化物对应水化物中碱性较强的是 (填化学式).
(3)写出③的单质在⑥单质中燃烧的化学方程式
三、综合题
-
15. 推断题.
已知有A、B、C、D、E五种短周期的主族元素,它们的原子序数依次递增,A是所有元素中原子半径最小的元素,B、C组成的某一种化合物能引起温室效应.常温下,金属D单质投入水中能与水剧烈反应.常温下E单质是常见的气体.请按要求回答下列几个问题:
(1)、B、D的元素名称分别为:、;(2)、E在周期表中的位置为: ,(3)、C离子的结构示意图为:;(4)、B、C、D三种元素的原子半径从大到小的顺序为(用元素符号表示);(5)、B、E的最高价氧化物对应水化物的酸性从强到弱的顺序为:(用对应的化学式表示)(6)、写出C、D两种元素组成的阴、阳离子个数比为1:2且只含离子键的化合物的电子式:;(7)、写出E与水反应的离子方程式: .16. A,B,C,D,E是位于短周期的主族元素。已知:A、B、C、E在同一周期,在该周期元素中,A的原子半径最大,B的离子半径最小;A与B质子数之和是D质子数的3倍;C m- 、E (m-1)-具有相同的电子层结构;热稳定性:H mD>H mC。依据上述信息用相应的化学用语回答下列问题:(1)、H m D m 的电子式为(2)、C m- 、E (m-1)-的还原性强弱顺序为: , (用离子符号表示)能证明其还原性强弱的离子方程式为。(3)、B单质与A的最高价氧化物对应水化物反应的化学方程式为:。(4)、常温下,将CD m通入H m C溶液中,有C析出,写出该过程的化学方程式 。(5)、在A、B、C、E单质中,符合下列转化关系的是(填元素符号)。
-