备考2019年高考化学二轮专题 03 氧化还原反应
试卷更新日期:2019-02-21 类型:二轮复习
一、单选题
-
1. 下列说法不正确的是( )A、复分解反应一定不是氧化还原反应 B、置换反应一定是氧化还原反应 C、有单质参加的反应一定是氧化还原反应 D、部分分解反应是氧化还原反应2. 下列反应需要加入氧化剂才能实现的是( )A、Cl2→Cl- B、H+→H2 C、CO32-→CO2 D、Zn→Zn2+3. 已知反应:KClO3 + 6HCl = 3Cl2 + KCl + 3H2O下列说法正确的是( )A、反应中还原剂是HCl,还原产物是KCl B、氧化性强弱关系为:KClO3>Cl2 C、反应中氧化剂与还原剂的物质的量之比为1:6 D、当消耗1mol氧化剂时,反应中转移电子的物质的量为6mol4. 已知反应: ①Cl2+2KBr=2KCl+Br2 , ②KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O,
③2KBrO3+Cl2=Br2+2KClO3 , 下列说法正确的是 ( )
A、上述3个反应都是置换反应 B、③中1 mol 氧化剂参加反应得到电子的物质的量为10 NA C、反应②中若得到13.44L Cl2 , 则电子转移个数为6.02×1023 D、氧化性由强到弱的顺序为: KBrO3 > KClO3 > Cl2 > Br25. 用NA表示阿伏加德罗常数,下列说法错误的是( )A、1L 1mol/L NaCl溶液中含有钠离子的个数为NA B、在标准状况下,NA个水分子所占有的体积约为22.4L C、7.8g Na2O2中含有阴离子的数目为0.1NA D、0.1molCl2与足量的氢氧化钠溶液反应时,转移电子的数目为0.1NA6. 现有下列三个氧化还原反应① ② ③ ,根据上述反应,判断下列结论中正确的是()A、要除去含有 A2+、Z-和B-混合溶液中的A2+ , 而不氧化Z-和B- , 应加入B2 B、氧化性强弱顺序为:XO4->Z2>A3+>B2 C、X2+是XO4-的氧化产物,B2 是 B-的还原产物 D、在溶液中不可能发生反应: XO4-+5A2++8H+=X2++5A3++4H2O7. 已知I-、Fe2+、SO2、Cl-、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为SO2>I->H2O2>Fe2+>Cl- , 则下列反应不能发生的是()A、2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ B、I2+SO2+2H2O=H2SO4+2HI C、H2O2+H2SO4=SO2↑+O2↑+2H2O D、2Fe3++2I-=2Fe2++I28. 已知某厂排放的尾气中NO、NO2的体积比为1:1,该厂采用NaOH溶液来处理该尾气,处理后所得溶液中只有一种含氮的钠盐。则该含氮的钠盐中,氮元素的化合价为( )A、-3 B、+1 C、+3 D、+59. 下列化学方程式中,表示电子转移的方向和数目都正确的是( )A、 B、
B、 C、
C、 D、
D、 10. 常温下,在溶液中可发生以下反应:①2Fe2++Br2=2Fe3++2Br- , ②2Br-+Cl2=Br2+2Cl- , ③2Fe3++2I-=2Fe2++I2。由此判断下列说法错误的是( )A、铁元素在反应①和③中均被氧化 B、反应②中当有1 mol Cl2被还原时,有2mol Br-被氧化 C、氧化性强弱顺序为:Cl2>Br2>Fe3+>I2 D、还原性强弱顺序为:I->Fe2+>Br->Cl-11. 氯气与碱液反应时由于温度、浓度等不同,产物会有一些差异。若将足量氯气通入某温度下一定浓度的氢氧化钠溶液中,经检测反应后的溶液中含有NaCl、NaClO、NaClO3三种溶质,其中NaClO为0.2mol、NaClO3为0.1mol。据此推测不正确的是( )
10. 常温下,在溶液中可发生以下反应:①2Fe2++Br2=2Fe3++2Br- , ②2Br-+Cl2=Br2+2Cl- , ③2Fe3++2I-=2Fe2++I2。由此判断下列说法错误的是( )A、铁元素在反应①和③中均被氧化 B、反应②中当有1 mol Cl2被还原时,有2mol Br-被氧化 C、氧化性强弱顺序为:Cl2>Br2>Fe3+>I2 D、还原性强弱顺序为:I->Fe2+>Br->Cl-11. 氯气与碱液反应时由于温度、浓度等不同,产物会有一些差异。若将足量氯气通入某温度下一定浓度的氢氧化钠溶液中,经检测反应后的溶液中含有NaCl、NaClO、NaClO3三种溶质,其中NaClO为0.2mol、NaClO3为0.1mol。据此推测不正确的是( )
A、至少通入了标准状况下的氯气11.2L B、反应后的溶液中含有0.7mol NaCl C、反应转移的电子总物质的量为1.0mol D、氢氧化钠溶液中溶质为1.0mol二、填空题
-
12. 在反应 2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,氧化剂是 ,氧化产物是 ,氧化产物与还原产物的物质的量之比为 ,被氧化与未被氧化的HCl的质量之比为 ,若有73gHCl被氧化,电子转移的总数为 ,产生Cl2的质量为 g。13.
还原剂还原法、光催化氧化法、电化学吸收法是减少氮氧化物排放的有效措施.①TiO2在紫外线照射下会使空气中的某些分子产生活性基团OH-,OH-能将NO、NO2氧化,如图1所示,OH-与NO2的反应为NO2+OH-═HNO3 . 写出OH-与NO反应的化学方程式: .
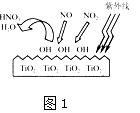
②如图2所示的装置能吸收和转化NO2、NO和SO2 , 阴极排出的溶液中含S2O42﹣离子,能吸收NOx气体,生成的SO32﹣可在阴极区再生.将S2O42﹣吸收NO2的离子方程式配平,并在方格内填上相应物质:
S2O42﹣+NO2+OH﹣═SO32﹣+N2+
 14. 常温下KMnO4氧化浓HCl的反应方程式如下:
14. 常温下KMnO4氧化浓HCl的反应方程式如下:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(1)、用“双线桥法”标明反应中电子转移的方向和数目(2)、又已知MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是: .
(3)、浓盐酸在反应中显示出来的性质是 (填编号)A只有还原性 B还原性和酸性 C只有氧化性 D氧化性和酸性
(4)、若有63.2g高锰酸钾参加反应,则被氧化的HCl的物质的量为 mol,产生的Cl2在标准状况下的体积为 L.