2019年初中化学中考复习 05 质量守恒定律
试卷更新日期:2019-02-21 类型:一轮复习
一、单选题
-
1. 下列反应的化学方程式书写正确的是()A、炼铁时用一氧化碳还原氧化铁:
 B、镁在空气中燃烧:
B、镁在空气中燃烧: 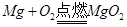 C、铁放入盐酸中反应:
C、铁放入盐酸中反应: 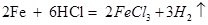 D、实验室制取二氧化碳:
D、实验室制取二氧化碳:  2. 分析下列化学反应,所得结论错误的是( )
2. 分析下列化学反应,所得结论错误的是( )2C+O2 2COC+O2 CO2 2CO+O2 2CO2
A、反应物相同,参加反应的物质的量不同时,生成物不同 B、碳、一氧化碳和天然气一样都可用作燃料 C、上述反应都是化合反应,且反应都放热 D、C→CO→CO2的转化都只能通过与O2反应来实现3. 如图所示的四个图象,能正确反映对应变化关系的是( )A、 镁在氧气中燃烧
B、
镁在氧气中燃烧
B、 向二氧化锰中加入过氧化氢溶液
C、
向二氧化锰中加入过氧化氢溶液
C、 用氯酸钾制取氧气
D、
用氯酸钾制取氧气
D、 煅烧一定质量的石灰石
4. 在反应A+2B=2C+3D中,已知A和B的相对分子质量之比为7∶8,当2.8 g A与一定量B恰好完全反应后,生成3.6 g D,则C的质量为( )A、8.8 g B、5.6 g C、6.8 g D、2.4 g5. a和b为两份质量相等的固体,已知a为氯酸钾,b为混有少量二氧化锰的氯酸钾。当分别同时加热a和b至完全反应时,能正确表示生成氧气的质量随加热时间而变化的图像是( )A、
煅烧一定质量的石灰石
4. 在反应A+2B=2C+3D中,已知A和B的相对分子质量之比为7∶8,当2.8 g A与一定量B恰好完全反应后,生成3.6 g D,则C的质量为( )A、8.8 g B、5.6 g C、6.8 g D、2.4 g5. a和b为两份质量相等的固体,已知a为氯酸钾,b为混有少量二氧化锰的氯酸钾。当分别同时加热a和b至完全反应时,能正确表示生成氧气的质量随加热时间而变化的图像是( )A、 B、
B、 C、
C、 D、
D、 6. 常用燃烧法测定有机物的组成。现取2.3g某有机物在足量的氧气中完全燃烧,生成4.4gCO2和2.7gH2O。对该物质的组成有下列推断:①一定含C、H元素②一定不含O元素③可能含O元素④一定含O元素⑤分子中C、H的原子个数比为2:5⑥分子中C、H、O的元素质量比为12:3:8。下列选项正确的是( )A、①②⑤ B、①④⑥ C、①③⑤ D、①④⑤7. 某纯净物3 g在氧气中完全燃烧,生成8.8g二氧化碳和5.4g水。下列说法错误的是()A、该反应中O2和CO2的质量比为14∶11 B、该纯净物中含有C,H元素,不含O元素 C、该纯净物中C,H原子的个数比为1∶4 D、该反应中O2和H2O的分子数之比为7∶68. 一定条件下,在一个密闭容器内发生某反应,测得反应前后各物质的质量如图所示,下列说法正确的是( )
6. 常用燃烧法测定有机物的组成。现取2.3g某有机物在足量的氧气中完全燃烧,生成4.4gCO2和2.7gH2O。对该物质的组成有下列推断:①一定含C、H元素②一定不含O元素③可能含O元素④一定含O元素⑤分子中C、H的原子个数比为2:5⑥分子中C、H、O的元素质量比为12:3:8。下列选项正确的是( )A、①②⑤ B、①④⑥ C、①③⑤ D、①④⑤7. 某纯净物3 g在氧气中完全燃烧,生成8.8g二氧化碳和5.4g水。下列说法错误的是()A、该反应中O2和CO2的质量比为14∶11 B、该纯净物中含有C,H元素,不含O元素 C、该纯净物中C,H原子的个数比为1∶4 D、该反应中O2和H2O的分子数之比为7∶68. 一定条件下,在一个密闭容器内发生某反应,测得反应前后各物质的质量如图所示,下列说法正确的是( ) A、x的值为22 B、该反应中的生成物是CO2、H2O和O2 C、W由碳、氢两种元素组成 D、W中碳、氢元素原子个数比为1∶49. 在一密闭容器中,盛放A、B、C三种物质各30g,经电火花引燃,充分反应后,各物质质量变化如下,关于此反应,下列认识错误的是()
A、x的值为22 B、该反应中的生成物是CO2、H2O和O2 C、W由碳、氢两种元素组成 D、W中碳、氢元素原子个数比为1∶49. 在一密闭容器中,盛放A、B、C三种物质各30g,经电火花引燃,充分反应后,各物质质量变化如下,关于此反应,下列认识错误的是()物质
A
B
C
D
反应前物质质量/g
30
30
30
0
反应后物质质量/g
待测
33
0
22
A、变化后待测的A质量为5g B、该变化的基本反应类型是分解反应 C、A物质有可能是单质,C物质一定是化合物 D、C物质中所含有的元素种类是A,B,D三种物质中所有元素种类之和10. 在一个密闭容器中放入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表:物质
甲
乙
丙
丁
反应前质量/g
18
1
2
32
反应后质量/g
X
26
2
12
下列说法中,错误的是()
A、反应后物质甲的质量为13g B、乙是反应物 C、反应中乙、丁的质量比为5∶4 D、物质丙可能是该反应的催化剂11. 实验室常用加热氯酸钾和二氧化锰的混合物制取氧气(2KClO3 2KCl+3O2↑),其受热过程中某变量y随时间变化趋势如图。纵坐标表示的是( ) A、固体中氧元素的质量 B、生成氧气的质量 C、固体中MnO2的质量 D、固体中氯元素的质量分数12. 下列四个图像中,能正确表示对应变化关系的是( )A、图1表示红磷在密闭容器内燃烧
A、固体中氧元素的质量 B、生成氧气的质量 C、固体中MnO2的质量 D、固体中氯元素的质量分数12. 下列四个图像中,能正确表示对应变化关系的是( )A、图1表示红磷在密闭容器内燃烧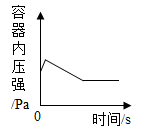 B、图2表示足量的Zn、Fe与等质量的相同稀HCl反应
B、图2表示足量的Zn、Fe与等质量的相同稀HCl反应 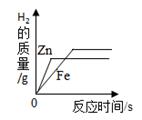 C、图3表示在有无MnO2的条件下,加热分解等质量的KClO3
C、图3表示在有无MnO2的条件下,加热分解等质量的KClO3  D、图4表示纯净的镁条在空气中燃烧
D、图4表示纯净的镁条在空气中燃烧 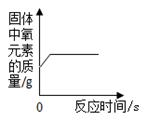
二、填空题
-
13. 化学中由宏观可知微观:气体X在氧气中燃烧生成氮气和水,X分子中一定含有的原子是和(填符号)。14. 将C2H5OH和O2置于密闭容器中,点燃使其恰好完全反应,产物为CO、CO2和H2O,待容器恢复至室温,测得容器内CO和CO2的混合气体中碳元素的质量分数为36%,则该反应的化学方程式为
15. 一定条件下,4.8 g CH4与12.8 g O2恰好完全反应,生成10.8 g H2O、5.6 g CO和物质X。则X的质量为g;该化学方程式为。
16. 学完质量守恒定律后,为加深同学们的理解,老师又演示了如下实验。
实验A中天平指针会(填“左偏”、“不变”或“右偏”)。燃烧掉的石蜡的质量(填“大于”、“小于”或“等于”)生成的二氧化碳和水蒸气的总质量。
17. 现有 6.4 g未知物和氧气充分反应,经测定生成 4.4 g二氧化碳、2.8 g一氧化碳和7.2 g 水,求出该未知物分子中所含原子的最简个数比。
三、实验探究题
-
18. 某同学用如下图所示的3个实验验证质量守恒定律:
 (1)、其中不能达到实验目的的是(填序号),理由是。(2)、实验A中观察到铁钉表面有 出现,证明铁钉与硫酸铜溶液发生了化学变化;实验B中如果去掉小气球并将玻璃管换成玻璃棒,可能造成的不良后果是 , 该反应的化学方程式是;(3)、请从微观的角度,简要分析你认为任何化学变化都遵守质量守恒定律的原因是:。(4)、反思:探究或验证反应物与生成物的质量关系时,若要用到有气体参加或有气体生成的反应,反应必须在的容器中进行.
(1)、其中不能达到实验目的的是(填序号),理由是。(2)、实验A中观察到铁钉表面有 出现,证明铁钉与硫酸铜溶液发生了化学变化;实验B中如果去掉小气球并将玻璃管换成玻璃棒,可能造成的不良后果是 , 该反应的化学方程式是;(3)、请从微观的角度,简要分析你认为任何化学变化都遵守质量守恒定律的原因是:。(4)、反思:探究或验证反应物与生成物的质量关系时,若要用到有气体参加或有气体生成的反应,反应必须在的容器中进行.四、计算题
-
19. 张南和化学兴趣小组的同学从内蒙古伊盟地区的天然碱湖带来一种“碱”样品(含 有碳酸钠、氯化钠和泥沙)。为测定这种样品(样品中的泥沙不参加反应,也不溶于水)中 碳酸钠的含量,并得到纯净的一定浓度的氯化钠溶液。进行了如下实验:
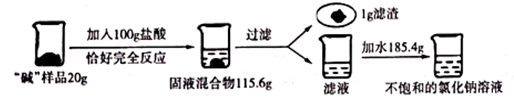
请回答下列问题:
(1)、写出发生反应的化学方程式;(2)、根据已知条件列出求解反应中生成氯化钠的质量(X)的比例式;(3)、该“碱”样品中碳酸钠的含量为;(4)、若最终得到的滤液为不饱和溶液,则所得滤液中溶质的质量分数为;(5)、若用36.5%的浓盐酸配制上述实验所用的稀盐酸,需浓盐酸的质量为。20. 化学兴趣小组为测定一批石灰石样品中碳酸钙的质量分数,取用20 g石灰石样品,进行高温煅烧(样品除碳酸钙外,其余成分高温不分解。碳酸钙高温分解的化学方程式为CaCO3 CaO+CO2↑),测得石灰石煅烧过程中的不同时段剩余固体质量如下表所示:煅烧的时间(min)
剩余固体的质量(g)
2
17.8
4
13.4
6
12.3
8
12.3
(1)、完全反应后生成二氧化碳的质量多少g。(2)、求石灰石样品中碳酸钙的质量分数。
-