广西百色市2017-2018学年高一下学期化学期末考试试卷
试卷更新日期:2019-02-20 类型:期末考试
一、单选题
-
1. 下列说法中正确的是( )A、石油液化气、汽油、地沟油加工制成的生物柴油都是碳氢化合物 B、石油通过催化裂化过程将重油裂化为汽油 C、聚乙烯塑料可用于食品包装,该塑料的老化是因为发生加成反应 D、医用酒精和葡萄糖注射液可用丁达尔效应区分2. 下面的烷烃是烯烃R和氢气发生加成反应后的产物,则R可能的结构简式有( )
 A、4种 B、5种 C、6种 D、7种3. 下列过程的离子方程式书写正确的是( )A、Cu与AgNO3溶液反应:Cu+Ag+=Ag+Cu2+ B、醋酸与氢氧化钠溶液反应:CH3COOH+OH-=CH3COO-+H2O C、碳酸氢钠与硫酸反应:CO32-+2H+=CO2↑+H2O D、铁与足量稀硝酸反应:3Fe+8H++2NO3-=2NO↑+3Fe2++4H2O4. 下列说法错误的是( )A、N2的电子式是
A、4种 B、5种 C、6种 D、7种3. 下列过程的离子方程式书写正确的是( )A、Cu与AgNO3溶液反应:Cu+Ag+=Ag+Cu2+ B、醋酸与氢氧化钠溶液反应:CH3COOH+OH-=CH3COO-+H2O C、碳酸氢钠与硫酸反应:CO32-+2H+=CO2↑+H2O D、铁与足量稀硝酸反应:3Fe+8H++2NO3-=2NO↑+3Fe2++4H2O4. 下列说法错误的是( )A、N2的电子式是 B、金刚石和石墨是同位素
C、1mol14NH4+含有中子7mol
D、周期表中第13纵行是ⅢA元素
5. 某无色溶液中加入铝片有氢气产生,则该溶液中一定能大量共存的离子组是( )A、Cl-、NO3-、Ba2+、Fe3+ B、SO42- 、H+、HCO3-、Na+ C、Na+、K+、SO42- 、Cl- D、NH4+、Ba 2+、Cl-、NO3-6. 设NA代表阿伏加德罗常数的值,下列说法正确的是( )A、常温下28gN2含有的电子数为10NA B、标准状况下,22.4LH2O含有的分子数是NA C、室温下44gCO2含有的分子数是NA D、100mL1mol·L-1盐酸中含有的HCl分子数是0.1NA7. 短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z位于同一主族,W与X可形成共价化合物WX2 , Y原子的内层电子总数是其最外层电子数的2.5倍。下列叙述错误的是( )A、原子半径的大小顺序为X<W<Y<Z B、WX2、YX2和ZX2均只含共价键 C、W、X、Y、Z最外层电子数之和为20 D、Z的气态氢化物比Y的稳定8. 控制适合的条件,将反应 设计成如右图所示的原电池。下列判断错误的是( )
B、金刚石和石墨是同位素
C、1mol14NH4+含有中子7mol
D、周期表中第13纵行是ⅢA元素
5. 某无色溶液中加入铝片有氢气产生,则该溶液中一定能大量共存的离子组是( )A、Cl-、NO3-、Ba2+、Fe3+ B、SO42- 、H+、HCO3-、Na+ C、Na+、K+、SO42- 、Cl- D、NH4+、Ba 2+、Cl-、NO3-6. 设NA代表阿伏加德罗常数的值,下列说法正确的是( )A、常温下28gN2含有的电子数为10NA B、标准状况下,22.4LH2O含有的分子数是NA C、室温下44gCO2含有的分子数是NA D、100mL1mol·L-1盐酸中含有的HCl分子数是0.1NA7. 短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z位于同一主族,W与X可形成共价化合物WX2 , Y原子的内层电子总数是其最外层电子数的2.5倍。下列叙述错误的是( )A、原子半径的大小顺序为X<W<Y<Z B、WX2、YX2和ZX2均只含共价键 C、W、X、Y、Z最外层电子数之和为20 D、Z的气态氢化物比Y的稳定8. 控制适合的条件,将反应 设计成如右图所示的原电池。下列判断错误的是( ) A、反应开始时,乙中石墨电极上发生氧化反应 B、反应开始时,甲中石墨电极上
A、反应开始时,乙中石墨电极上发生氧化反应 B、反应开始时,甲中石墨电极上 被还原
C、电流计读数为零时,反应达到化学平衡状态
D、电流计读数为零后,在甲中溶入
被还原
C、电流计读数为零时,反应达到化学平衡状态
D、电流计读数为零后,在甲中溶入  固体,乙中的石墨电极为负极
9. 某烃完全燃烧时,消耗的氧气与生成的CO2体积比为3∶2,该烃能使酸性高锰酸钾溶液褪色,也能使溴水褪色,则该烃的分子式可能为( )A、C3H4 B、C2H4 C、C2H6 D、C6H610. 下图中左图是铜锌原电池示意图,右图中x轴表示实验时流入正极的电子的物质的量,y轴表示( )
固体,乙中的石墨电极为负极
9. 某烃完全燃烧时,消耗的氧气与生成的CO2体积比为3∶2,该烃能使酸性高锰酸钾溶液褪色,也能使溴水褪色,则该烃的分子式可能为( )A、C3H4 B、C2H4 C、C2H6 D、C6H610. 下图中左图是铜锌原电池示意图,右图中x轴表示实验时流入正极的电子的物质的量,y轴表示( ) A、铜棒的质量 B、c(H+) C、c(SO42-) D、C(Zn2+)11. 短周期元素X、Y、Z原子序数和为36,X、Y在同一周期,X+、Z2-具有相同的核外电子层结构。下列推测错误的是( )A、同周期元素中X的金属性最强 B、X、Z形成的化合物只含有离子键 C、同族元素中Z的氢化物稳定性最高 D、同周期元素中Y的最高价含氧酸的酸性最强12. 可逆反应:X(s)+Y(g) 2Z(g)在容积为1L密闭容器反应,下列叙述不是反应达到平衡状态的标志的是( )
A、铜棒的质量 B、c(H+) C、c(SO42-) D、C(Zn2+)11. 短周期元素X、Y、Z原子序数和为36,X、Y在同一周期,X+、Z2-具有相同的核外电子层结构。下列推测错误的是( )A、同周期元素中X的金属性最强 B、X、Z形成的化合物只含有离子键 C、同族元素中Z的氢化物稳定性最高 D、同周期元素中Y的最高价含氧酸的酸性最强12. 可逆反应:X(s)+Y(g) 2Z(g)在容积为1L密闭容器反应,下列叙述不是反应达到平衡状态的标志的是( )①单位时间内生成1molX的同时消耗2molZ ②Z的体积分数不再变化
③体系的压强不再改变 ④Y、Z的物质的量浓度比为1:2
⑤Y的转化率不再改变的状态 ⑥混合气体的密度不再改变的状态
A、仅①④ B、①③④ C、①④⑤ D、②③⑤⑥13. 海带中提取碘单质,成熟的工艺流程如下
下列关于海水制碘的说法,正确的是( )
A、实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌 B、可用酒精萃取碘水中的I2 C、沸水浸泡海带灰的目的是为了加快I-的溶解,并使之溶解更充分 D、含I-的滤液中加入稀硫酸和双氧水后,碘元素发生还原反应14. 今有五种有机物:①CH2OH(CHOH)4CHO,②CH3(CH2)3OH,③CH2=CH—CH2OH,④CH2=CH-COOCH3 , ⑤CH2=CH-COOH。其中既能发生加成反应、加聚反应、酯化反应,又能发生氧化反应的是( )A、③⑤ B、①②⑤ C、②④ D、③④15. 下列由实验得出的结论正确的是( )实验
结论
A.
某有机物完全燃烧,只生成CO2和H2O
该有机物一定含有碳氢两元素,不能确定是否含氧元素
B.
乙醇和水都可与金属钠反应产生可燃性气体
乙醇分子中的氢与水分子中的氢具有相同的活性
C.
用乙酸浸泡水壶中的水垢,可将其清除
乙酸的酸性小于碳酸的酸性
D.
甲烷与氯气在光源下反应后的混合气体能使湿润的石蕊试纸变红
生产的氯甲烷具有酸性
A、A B、B C、C D、D二、推断题
-
16. 短周期元素A、B、C、D、E在周期表中的位置如图所示,A、B、C、D位于连续的四个主族,D、E的质子数和是20。
D
A
B
C
E
回答下列问题:
(1)、C元素在周期表中的位置是;E元素的名称是。(2)、A元素与氧元素形成的原子个数比是1:1的化合物的化学式是 , 该化合物含有的化学键类型是。(3)、B原子结构示意图是 , 从原子结构角度分析,B比C活泼性大的原因是。(4)、元素D比元素E的非金属性强的理由是(用化学方程式表示)。(5)、A,B,C,D离子半径由大到小的顺序是(填写离子符号)。(6)、将B、C的单质压成薄片用导线连接后浸入稀硫酸中,能量主要转化方式是 , 正极反应式是。三、实验题
-
17. 某实验小组测定镁、铝合金中镁的质量分数。甲小组同学称量3.9g合金按照下图进行实验。
 (1)、仪器A的名称是。(2)、检查装置气密性的方法是。(3)、检查装置气密性好后开始实验,滴加稀硫酸时开始没有气泡产生,你认为可能的原因是。(4)、若测得气体的体积是4.48L(转化为标准状况下),则合金中镁的质量分数是 , 若读数时没有冷却到室温读数,测得合金中镁的质量分数(填写“偏大”或“偏小”)。(5)、下列实验方案中能测定镁的质量分数的是。
(1)、仪器A的名称是。(2)、检查装置气密性的方法是。(3)、检查装置气密性好后开始实验,滴加稀硫酸时开始没有气泡产生,你认为可能的原因是。(4)、若测得气体的体积是4.48L(转化为标准状况下),则合金中镁的质量分数是 , 若读数时没有冷却到室温读数,测得合金中镁的质量分数(填写“偏大”或“偏小”)。(5)、下列实验方案中能测定镁的质量分数的是。A.W1gMg、Al合金量 固体→洗涤、干燥称量质量为W2g
B.W1gMg、Al合金 固体→洗涤、干燥称量质量为W2g
C.W1gMg、Al合金 排水量气测得气体体积为V2L(转化为标况)
D.W1gMg、Al合金 溶液 沉淀→洗涤、干燥称量质量为W2g
四、综合题
-
18. 工业上合成氨反应为:N2+3H2 2NH3 , 回答下列问题:(1)、反应过程中拆开的化学键是;(2)、反应放热,从价键角度分析,反应放热的原因是 , 下列图像正确的是。
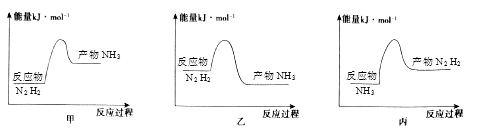 (3)、在体积是2L的密闭容器中开始加入1molN2 , 3molH2 , 反应过程浓度中,物质的浓度与时间的关系如图所示。
(3)、在体积是2L的密闭容器中开始加入1molN2 , 3molH2 , 反应过程浓度中,物质的浓度与时间的关系如图所示。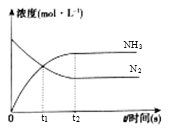
①t1时生成NH3的物质的量是;用H2表示的化学反应速率υ(H2)=。
②下列各项能表明反应达到化学平衡状态的是。
A.容器中气体的密度保持不变
B.容器中气体的压强不变
C.氨气的含量不变
D.拆开3molH-H键同时形成6molN-H键
(4)、下列措施中能提高合成氨反应化学反应速率的是。A.使用高效催化剂
B.恒温恒容再充入氢气
C.降低反应温度
D.扩大容器体积
19.(1)、某有机物由C、H、O三种元素组成,球棍模型如图所示:
①含有的官能团名称是;
②写出此有机物与金属钠反应的化学方程式。
(2)、四种常见有机物分子的比例模型示意图如下,其中甲、乙、丙为烃,丁为烃的衍生物。
①可以鉴别甲和乙的试剂为;
a.稀硫酸
b.溴的四氯化碳溶液
c.水
d.酸性高锰酸钾溶液
②上述物质中有毒、有特殊气味,且不溶于水、密度比水小的是(填名称),将其加入溴水中,振荡后静置,观察到的现象是。
③乙和丁的物质的量共1.5mol,完全燃烧需要的氧气的物质的量是。
(3)、乳酸( )是一种有机物,它在多种生物化学过程中起重要作用。
)是一种有机物,它在多种生物化学过程中起重要作用。 ①1mol乳酸与足量的Na反应生成氢气的物质的量是。
②乳酸与铁粉反应生成乳酸亚铁,可用于治疗缺铁性贫血。反应的化学方程式是。
-
-