2018-2019学年粤教版化学九年级下册 8.3酸和碱的反应 同步训练
试卷更新日期:2019-02-15 类型:同步测试
一、单选题
-
1. 对下列事实的解释错误的是( )
序号
事 实
解 释
A
往养鱼池中通入空气
增大水中氧气的溶解量
B
敞口放置在空气中的浓硫酸变稀
浓硫酸具有吸水性,能吸收空气中的水分
C
氢氧化钠溶液导电
氢氧化钠自身含有自由移动的粒子
D
餐具洗涤剂能除去餐具上的油污
餐具洗涤剂有乳化作用
A、A B、B C、C D、D2. 2018年10月16日哈尔滨市区开始了第一天供暖。冬天来了树叶落了,请同学们防寒保暖,健康饮食,锻炼身体。下面相关说法正确的是( )



A.树木上涂刷防止冻伤的石灰浆,主要成分是碳酸钙
B.胃酸过多的人应多吃苹果、橘子
C.多喝可乐不利于身体健康,可乐中含有碳酸,紫色石蕊溶液能使碳酸变红色
D.骑自行车锻炼身体,自行车车架的金属材料可以是锰钢的
A、A B、B C、C D、D3. 了解溶液的酸碱性对于生活、生产以及人类的生命活动有重要的意义。下列说法正确的是( )A、厕所清洁剂呈酸性 B、浓硫酸不慎沾到皮肤上,应立即用大量水冲洗,再涂上3%—5%的硼酸 C、人体胃液正常的pH范围在0.5—1.9 D、用熟石灰改良碱性土壤4. 下列反应属于中和反应的是( )A、SO2+2NaOH=Na2SO3+H2O B、CaO+2HCl=CaCl2+H2O C、KOH+HCl=KCl+H2O D、CaO+H2O=Ca(OH)25. 如图是氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图,由此得出的结论正确的是( )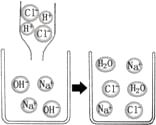 A、反应后溶液的pH大于7 B、反应前的溶液均可导电,反应后的溶液不导电 C、反应后溶液中存在的粒子只有Na+和Cl― D、反应前后所有元素的化合价均无变化6. 氢氧化钠溶液、氢氧化钾溶液和氢氧化钙溶液具有相似的化学性质,其本质原因是( )A、都能离解出金属离子 B、都能使指示剂变色 C、都能离解出氢氧根离子 D、都能与酸反应生成盐和水7. 下列反应中属于复分解反应的是( )A、2Mg+ O2 2MgO B、Cu+2AgNO3=Cu(NO3)2+2Ag C、CuCl2 Cu+Cl2↑ D、2NaOH+H2SO4=Na2SO4+2H2O8. 向某稀盐酸中逐渐加入试剂X后溶液的pH变化如图。试剂X可能是下列物质中的( )
A、反应后溶液的pH大于7 B、反应前的溶液均可导电,反应后的溶液不导电 C、反应后溶液中存在的粒子只有Na+和Cl― D、反应前后所有元素的化合价均无变化6. 氢氧化钠溶液、氢氧化钾溶液和氢氧化钙溶液具有相似的化学性质,其本质原因是( )A、都能离解出金属离子 B、都能使指示剂变色 C、都能离解出氢氧根离子 D、都能与酸反应生成盐和水7. 下列反应中属于复分解反应的是( )A、2Mg+ O2 2MgO B、Cu+2AgNO3=Cu(NO3)2+2Ag C、CuCl2 Cu+Cl2↑ D、2NaOH+H2SO4=Na2SO4+2H2O8. 向某稀盐酸中逐渐加入试剂X后溶液的pH变化如图。试剂X可能是下列物质中的( )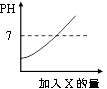 A、H2O B、H2SO4 C、NaOH D、CaCO39. 根据下图所示的四个实验,得出的结论正确的是( )
A、H2O B、H2SO4 C、NaOH D、CaCO39. 根据下图所示的四个实验,得出的结论正确的是( ) A、乙试管中产生气泡速率大于甲试管中产生气泡速率,说明金属活动性:镁>铁 B、蜡烛由低到高依次熄灭,说明通常状况下CO2不能燃烧,不支持燃烧,密度大于空气 C、甲试管中的铁钉生锈,乙试管中的铁钉不生锈,说明只需与水接触铁钉就会生锈 D、向盛有NaOH固体的试管中滴加稀硫酸,烧杯中饱和的澄清石灰水变浑浊,说明H2SO4与NaOH发生中和反应放出热量10. 某校化学小组在利用硫酸和氢氧化钠溶液探究酸碱中和反应时,测得烧杯中溶液 pH 的变化如图所示。下列说法正确的是( )
A、乙试管中产生气泡速率大于甲试管中产生气泡速率,说明金属活动性:镁>铁 B、蜡烛由低到高依次熄灭,说明通常状况下CO2不能燃烧,不支持燃烧,密度大于空气 C、甲试管中的铁钉生锈,乙试管中的铁钉不生锈,说明只需与水接触铁钉就会生锈 D、向盛有NaOH固体的试管中滴加稀硫酸,烧杯中饱和的澄清石灰水变浑浊,说明H2SO4与NaOH发生中和反应放出热量10. 某校化学小组在利用硫酸和氢氧化钠溶液探究酸碱中和反应时,测得烧杯中溶液 pH 的变化如图所示。下列说法正确的是( )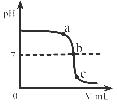 A、a 点所示溶液呈酸性 B、向 b 点所示溶液中滴加石蕊溶液,溶液呈紫色 C、该实验是将 NaOH 溶液逐滴滴入稀硫酸中 D、c 点所示溶液中,含有的溶质是 Na2SO4和 NaOH
A、a 点所示溶液呈酸性 B、向 b 点所示溶液中滴加石蕊溶液,溶液呈紫色 C、该实验是将 NaOH 溶液逐滴滴入稀硫酸中 D、c 点所示溶液中,含有的溶质是 Na2SO4和 NaOH二、填空题
-
11. 大多数农作物适易在性和性的土壤中生长,正常雨水呈酸性的原因为 . (写方程式)12. 正常的雨水因溶有而呈弱酸性,通常将pH小于的雨、雪、雾、雹、露、霜等称为酸雨。SO2、、NOx、含氯化合物等物质的排放是形成酸雨的主要原因。我国主要是型酸雨,其形成过程有两种途径:一种是SO2在空气中的飘尘做催化剂的作用下被氧气氧化为SO3 , 溶于水生成硫酸,写出有关的反应化学方程式、;另一种是SO2溶于水生成亚硫酸,再被空气中的氧气氧化成硫酸,写出有关的反应化学方程式、。由于SO2的氧化非常缓慢,故后一种途径是其主要形成过程。13. 硫酸厂的废水中因含硫酸而显酸性,需要处理呈中性后才能排放.某兴趣小组的同学取少量废水按下列步骤进行实验.
第一步:验证废水酸性.往废水中滴加石蕊试液,石蕊变 , 说明废水呈酸性.
第二步:处理废水.该小组同学设计了以下两个方案.
方案一:用熟石灰处理废水,其反应的化学方程式为 .
方案二:用BaCl2处理废水,观察到废水中出现 .
经过分析,同学们认为方案二没有达到处理废水的目的,因为处理后的废水中含有较多的 .
14. 下表是从物质分类的角度认识部分酸碱盐的反应规律。①请完成下表
序
列
物质分类的角度
实例
化学方程式
反应物
生成物
1
盐和碱
盐和碱
碳酸钠和氢氧化钡
Na2CO3+Ba(OH)2→BaCO3↓+2NaOH
2
酸和金属
盐和氢气
铁和稀硫酸
3
盐和盐
盐和盐
硝酸银和
4
盐和金属
盐和金属
锌和硫酸铜溶液
②表中属于复分解反应的有个;“锌和硫酸铜溶液”反应中现象是。
③可见,生成盐的途径有多种。当生成物中有硫酸钠时,可以是硫酸和氢氧化钠的反应,也可以是和(写出具体物质的名称或化学式,酸和碱反应除外)。
④除了表中所列,盐还能与(填物质类别名称)反应。
三、实验探究题
-
15. 某兴趣小组的同学们围绕“酸碱中和反应”,将学生成分若干小组开探究活动。请你和他们一起完成以下实验探究。
(1)、(提出问题一)稀硫酸与氢氧化钠溶液能否发生反应(实验探究1)甲组同学在烧杯中加入10mL稀硫酸。滴入几滴酚酞试液,接着分两次向烧杯中滴入氢氧化钠溶液。第一次滴加几滴氢氧化钠溶液后,不断搅拌,第二次继续滴加氢氧化钠溶液至过量。则第一次滴加氢氧化钠溶液时,溶液中溶质(不考虑酚酞)的质量变化情况是;第二次滴加氢氧化钠溶液时观察到的现象是。由上述实验甲组同学得出了稀硫酸与氢氧化钠溶液能发生反应的结论。反应的化学方程为。
(2)、(提出问题二)是否可以用其他试剂证明稀硫酸与氢氧化钠溶液能发生反应呢?(实验探究2)同学们想要利用找到的生锈的铁钉继续探究,并设计了如下实验方案。
乙组同学的实验过程如图所示:向a试管中滴加氢氧 化钠溶液时无明显现象,再将混合后的溶液倒入盛有生锈铁钉的另一试管中,观察到的明显现象。
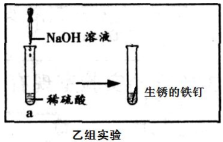
乙组结论:生锈的铁钉可以证明稀硫酸与氢氧化钠溶液能发生反应。
丙组同学的实验过程与乙组相同,但是丙组同学却未观察到明显现象。
丙组结论:生锈的铁钉可以证明稀硫酸与氢氧化钠溶液能发生反应。
(3)、(交流讨论)你认为乙、丙两组中哪个小组由实验现象获得的结论是正确的,并说明理由。(4)、(反思)若化学反应无明显现象时,可通过证明来判断有化学反应发生。16. 经过一年的学习,我们对“酸碱盐”有了一定的认识,请回答下列有关问题.(1)、下列说法中不正确的是 .A、酸和碱中一定都含有氢元素 B、氯化钠由氯化钠离子构成 C、多数酸和碱都有腐蚀性 D、浓硫酸可用作某些气体的干燥剂(2)、在用稀盐酸和氢氧化钠溶液进行中和反应的实验时,反应过程中溶液的酸碱度变化如图所示,该图横坐标代表的是溶液的质量.当加入该溶液的质量为ag时,所得溶液中含量最多的溶质为(写化学式) .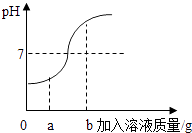 (3)、某敞口放置的氢氧化钠溶液已经变质,请用化学方程式表示其变质的原因.(4)、为了证明该瓶氢氧化钠溶液未完全变质,进行了以下实验,请将如表填写完整.
(3)、某敞口放置的氢氧化钠溶液已经变质,请用化学方程式表示其变质的原因.(4)、为了证明该瓶氢氧化钠溶液未完全变质,进行了以下实验,请将如表填写完整.实验操作
现象
结论或化学方程式
取少量该样品,滴加足量的
溶液,过滤
有白色沉淀生成
方程式为:
在滤液中滴加酚酞溶液
样品未完全变质
(5)、现有部分变质的氢氧化钠样品18.6g与146g溶质质量分数为10%的盐酸溶液恰好完全反应生成CO24.4g,计算样品中NaOH的质量分数?四、计算题
-
17. 将20.0g稀盐酸逐滴加入到10.0g溶质质量分数为40%的氢氧化钠溶液中,边滴加边搅拌,随着稀盐酸的滴加,溶液的pH变化情况如图所示,溶液的温度变化如表所示(不考虑反应过程中热量散失)

反应时间(s)
0
10
20
30
40
50
60
溶液温度(℃)
20.5
20.6
20.7
20.8
20.9
20.8
20.7
(1)、当稀盐酸与氢氧化钠溶液恰好完全反应时,溶液的温度是℃
(2)、计算稀盐酸中溶质的质量分数(精确到0.1%)