山东省济宁市2018-2019学年高三上学期化学期末考试试卷
试卷更新日期:2019-02-14 类型:期末考试
一、单选题
-
1. 清初《泉州府志》物产条载:“初,人不知盖泥法,元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之。”文中“盖泥法”的原理与下列相同的是( )A、活性炭净水 B、用漂白粉漂白织物 C、除去KNO3中的NaCl D、除去河水中泥沙2. 下列有关物质性质与用途说法对应正确的是( )A、胶体的胶粒带电,利用这一性质可进行“血液透析”和“静电除尘” B、CaO能与SO2反应,可作工业废气脱硫剂 C、NaHCO3能与碱反应,因此食品工业上可用作焙制糕点的膨松剂 D、SO2和湿润的O3都有漂白性,混合后得到漂白性更强漂白剂3. 下列说法中正确的是( )A、钢铁水闸可用牺牲阳极的阴极保护法或外加电流的阴极保护法进行防护 B、电解水生成H2和O2的实验中,可加入少量盐酸或硫酸增强导电性 C、同一可逆反应使用不同的催化剂时,高效催化剂可增大平衡转化率 D、升高温度能使吸热反应速率加快,使放热反应速率减慢4. 下列离子方程式正确的是( )A、氯气溶于水:Cl2+H2O
 2H++Cl-+ClO-
B、钠与水反应:Na+2H2O=Na++2OH-+H2↑
C、氧化亚铁溶于稀硝酸:FeO+2H+=Fe2++H2O
D、KI溶液久置空气中变黄色:4I-+O2+2H2O=2I2+4OH-
5. 下列关于某些离子的检验及结论,一定正确的是( )A、加入稀盐酸产生无色气体,将该气体通入澄清石灰水中变浑浊,则一定有CO32- B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则一定有SO42- C、加入浓烧碱溶液加热,产生的气体能使湿润的红色石蕊试纸变蓝,则一定有NH4+ D、加入Na2CO3溶液产生白色沉淀,再加盐酸,白色沉淀消失,则一定有Ba2+6. 图中所示的装置图能够达到实验目的是( )A、配制一定浓度的NaOH溶液
2H++Cl-+ClO-
B、钠与水反应:Na+2H2O=Na++2OH-+H2↑
C、氧化亚铁溶于稀硝酸:FeO+2H+=Fe2++H2O
D、KI溶液久置空气中变黄色:4I-+O2+2H2O=2I2+4OH-
5. 下列关于某些离子的检验及结论,一定正确的是( )A、加入稀盐酸产生无色气体,将该气体通入澄清石灰水中变浑浊,则一定有CO32- B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则一定有SO42- C、加入浓烧碱溶液加热,产生的气体能使湿润的红色石蕊试纸变蓝,则一定有NH4+ D、加入Na2CO3溶液产生白色沉淀,再加盐酸,白色沉淀消失,则一定有Ba2+6. 图中所示的装置图能够达到实验目的是( )A、配制一定浓度的NaOH溶液 B、中和热的测定
B、中和热的测定  C、加热熔融NaOH固体
C、加热熔融NaOH固体  D、测定高锰酸钾溶液的浓度
D、测定高锰酸钾溶液的浓度  7. 下列说法正确的是( )A、吸热反应一定不能自发进行 B、由 C(s,石墨)= C(s,金刚石) ∆H= +1.9kJ·mol−1 , 可知金刚石比石墨稳定 C、S(s)+O2(g)=SO2(g) ∆H1 , S(g)+ O2(g)=SO2( g) ∆H2 , 则∆H1>∆H2 D、已知 H+(aq)+OH−(aq)=H2O(l);∆H=-57.3kJ·mol−1 , 则 0.5mol H2SO4 与 0.5mol B a(OH)2 反应一定放出 57.3kJ 热量8. 下列有关实验操作的叙述正确的是( )A、滴加试剂时,滴管的尖嘴不可接触试管内壁 B、过滤操作中,漏斗的尖端不可接触烧杯内壁 C、滴定接近终点时,滴定管的尖嘴不可接触锥形瓶内壁 D、向容量瓶转移液体时,引流用玻璃棒不可接触容量瓶内壁9. 下列说法正确的是( )A、分馏石油可以得到植物油、柴油、润滑油 B、油脂、糖类和蛋白质都能发生水解反应 C、淀粉溶液中加入硫酸,加热4—5min,再加入少量银氨溶液加热,有光亮银镜生成 D、在大豆蛋白溶液中,加入硫酸铜溶液,蛋白质会发生变性10. 设NA为阿伏加德罗常数值。下列有关叙述正确的是( )A、1mol SO2溶于足量水,溶液中H2SO4、HSO3-与SO32-粒子的物质的量之和为NA B、0.2mol NO和0.1molO2充分反应后,混合物的分子数为0.2 NA C、64g铜丝加热下在硫磺蒸气里完全反应后,失去的电子数为NA D、1L 1mol·L-1Ca(ClO)2溶液中含ClO-的数目为2NA11. 一定条件下,下列各组物质能一步实现
7. 下列说法正确的是( )A、吸热反应一定不能自发进行 B、由 C(s,石墨)= C(s,金刚石) ∆H= +1.9kJ·mol−1 , 可知金刚石比石墨稳定 C、S(s)+O2(g)=SO2(g) ∆H1 , S(g)+ O2(g)=SO2( g) ∆H2 , 则∆H1>∆H2 D、已知 H+(aq)+OH−(aq)=H2O(l);∆H=-57.3kJ·mol−1 , 则 0.5mol H2SO4 与 0.5mol B a(OH)2 反应一定放出 57.3kJ 热量8. 下列有关实验操作的叙述正确的是( )A、滴加试剂时,滴管的尖嘴不可接触试管内壁 B、过滤操作中,漏斗的尖端不可接触烧杯内壁 C、滴定接近终点时,滴定管的尖嘴不可接触锥形瓶内壁 D、向容量瓶转移液体时,引流用玻璃棒不可接触容量瓶内壁9. 下列说法正确的是( )A、分馏石油可以得到植物油、柴油、润滑油 B、油脂、糖类和蛋白质都能发生水解反应 C、淀粉溶液中加入硫酸,加热4—5min,再加入少量银氨溶液加热,有光亮银镜生成 D、在大豆蛋白溶液中,加入硫酸铜溶液,蛋白质会发生变性10. 设NA为阿伏加德罗常数值。下列有关叙述正确的是( )A、1mol SO2溶于足量水,溶液中H2SO4、HSO3-与SO32-粒子的物质的量之和为NA B、0.2mol NO和0.1molO2充分反应后,混合物的分子数为0.2 NA C、64g铜丝加热下在硫磺蒸气里完全反应后,失去的电子数为NA D、1L 1mol·L-1Ca(ClO)2溶液中含ClO-的数目为2NA11. 一定条件下,下列各组物质能一步实现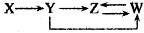 转化关系的是( )
转化关系的是( ) 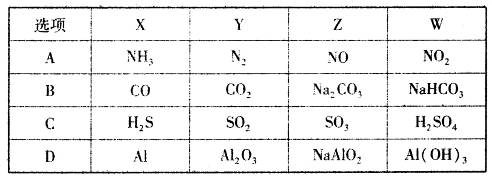 A、A B、B C、C D、D12. 已知W、X、Y、Z为原子序数依次增大的四种短周期元素。W、Z同主族,X、Y、Z同周期,其中只有X为金属元素,Z元素原子的最外层电子数是其电子层数的2倍。下列说法错误的是( )A、X与W形成化合物与稀盐酸反应不可能产生氧气 B、原子半径:X>Y>Z>W C、简单氢化物的稳定性:W>Z>Y D、Y与W形成化合物能与NaOH溶液反应13. 如图是一个用铂丝作电极,电解MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色。(指示剂的pH变色范围:6.8—8.0,酸色—红色,碱色—黄色,Mg(OH)2沉淀的pH=9),下列叙述错误的是( )
A、A B、B C、C D、D12. 已知W、X、Y、Z为原子序数依次增大的四种短周期元素。W、Z同主族,X、Y、Z同周期,其中只有X为金属元素,Z元素原子的最外层电子数是其电子层数的2倍。下列说法错误的是( )A、X与W形成化合物与稀盐酸反应不可能产生氧气 B、原子半径:X>Y>Z>W C、简单氢化物的稳定性:W>Z>Y D、Y与W形成化合物能与NaOH溶液反应13. 如图是一个用铂丝作电极,电解MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色。(指示剂的pH变色范围:6.8—8.0,酸色—红色,碱色—黄色,Mg(OH)2沉淀的pH=9),下列叙述错误的是( ) A、电解过程中电极附近溶液颜色变化是A管溶液由红变黄,B管溶液不变色 B、A管中发生的反应:2H2O+2e-+Mg2+=H2↑+Mg(OH)2↓ C、取出a试管,将带有火星的木条伸入试管内,看到木条复燃 D、电解一段时间后,A管产生白色沉淀,切断电源,将电解液倒入烧杯内,白色沉淀溶解或部分溶解14. 工业上以某软锰矿(主要成分为MnO2 , 还含有SiO2、Al2O3等杂质)为原料,利用烟道气中的SO2制备MnSO4·H2O的流程如下:
A、电解过程中电极附近溶液颜色变化是A管溶液由红变黄,B管溶液不变色 B、A管中发生的反应:2H2O+2e-+Mg2+=H2↑+Mg(OH)2↓ C、取出a试管,将带有火星的木条伸入试管内,看到木条复燃 D、电解一段时间后,A管产生白色沉淀,切断电源,将电解液倒入烧杯内,白色沉淀溶解或部分溶解14. 工业上以某软锰矿(主要成分为MnO2 , 还含有SiO2、Al2O3等杂质)为原料,利用烟道气中的SO2制备MnSO4·H2O的流程如下: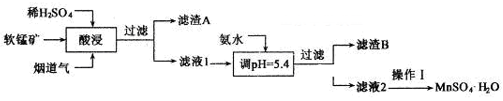
下列说法错误的是( )
A、滤渣A的主要成分能导电,可制备光导纤维 B、“酸浸”主要反应的离子方程式为MnO2+SO2=Mn2++SO42- C、加氨水调节pH的目的是除Al3+ D、操作I为结晶、过滤、洗涤、干燥15. 根据下列实验操作和现象所得到的结论正确的是( ) A、A B、B C、C D、D16. 锂—铜空气燃料电池是低成本高效电池。该电池通过一种复杂的铜“腐蚀”现象产生电能,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-。下列说法错误的是( )
A、A B、B C、C D、D16. 锂—铜空气燃料电池是低成本高效电池。该电池通过一种复杂的铜“腐蚀”现象产生电能,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-。下列说法错误的是( ) A、放电时,Li+透过固体电解质向Cu极移动 B、通空气时,铜被腐蚀,产生Cu2O C、放电时,正极的电极反应式为:Cu2O+2H+ +2 e- =2Cu+H2O D、整个反应过程中,氧化剂为O217. 25℃时,用NaOH溶液滴定H2C2O4溶液,溶液中 和 [或 和 ]的关系如图所示。下列说法错误的是( )
A、放电时,Li+透过固体电解质向Cu极移动 B、通空气时,铜被腐蚀,产生Cu2O C、放电时,正极的电极反应式为:Cu2O+2H+ +2 e- =2Cu+H2O D、整个反应过程中,氧化剂为O217. 25℃时,用NaOH溶液滴定H2C2O4溶液,溶液中 和 [或 和 ]的关系如图所示。下列说法错误的是( ) A、曲线M表示
A、曲线M表示 和
和  的关系
B、Ka1(H2C2O4)的数量级为10-2
C、向NaHC2O4溶液中加少量NaOH至c(HC2O4-)和c(C2O42-)相等,此时溶液pH约为5
D、在NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
18. 向两份等体积、等浓度、pH不同的FeSO4溶液中逐滴加入NaClO溶液,实验测得溶液pH随加入NaClO溶液体积变化曲线如下图。已知实验现象:I.滴入V1 mL NaClO溶液产生大量红褐色沉淀;II.滴入V1mL NaClO溶液,溶液变黄,未见沉淀,继续滴加,出现红褐色沉淀。下列说法错误的是( )
的关系
B、Ka1(H2C2O4)的数量级为10-2
C、向NaHC2O4溶液中加少量NaOH至c(HC2O4-)和c(C2O42-)相等,此时溶液pH约为5
D、在NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
18. 向两份等体积、等浓度、pH不同的FeSO4溶液中逐滴加入NaClO溶液,实验测得溶液pH随加入NaClO溶液体积变化曲线如下图。已知实验现象:I.滴入V1 mL NaClO溶液产生大量红褐色沉淀;II.滴入V1mL NaClO溶液,溶液变黄,未见沉淀,继续滴加,出现红褐色沉淀。下列说法错误的是( ) A、a~b段主要反应的离子方程式为:2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+ B、d~e段主要反应的离子方程式为:2Fe2++2ClO-+3H+=HClO+Cl-+2Fe3++H2O C、c、f点pH接近的主要原因是:ClO-+H2O
A、a~b段主要反应的离子方程式为:2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+ B、d~e段主要反应的离子方程式为:2Fe2++2ClO-+3H+=HClO+Cl-+2Fe3++H2O C、c、f点pH接近的主要原因是:ClO-+H2O HClO+OH-
D、向c点溶液中加入过量的浓盐酸,沉淀溶解并有刺激性气味的气体放出
HClO+OH-
D、向c点溶液中加入过量的浓盐酸,沉淀溶解并有刺激性气味的气体放出
二、多选题
-
19. 碳热还原制备氮化铝的总反应化学方程式为:Al2O3(s)+3C(s)+N2(g) 2AlN(s)+3CO(g)。在温度、容积恒定的反应体系中,CO浓度随时间的变化关系如图曲线甲所示。下列说法错误的是( )
 A、在不同时刻都存在关系:3v(N2)= v(CO) B、c点切线的斜率表示该化学反应在t时刻的瞬时速率 C、从a、b两点坐标可求得从a到b时间间隔内该化学反应的平均速率 D、维持温度、容积不变,若减少N2的物质的量进行反应,曲线甲将转变为曲线乙
A、在不同时刻都存在关系:3v(N2)= v(CO) B、c点切线的斜率表示该化学反应在t时刻的瞬时速率 C、从a、b两点坐标可求得从a到b时间间隔内该化学反应的平均速率 D、维持温度、容积不变,若减少N2的物质的量进行反应,曲线甲将转变为曲线乙三、实验题
-
20. Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8℃,42℃以上分解为Cl2和O2 , 可作为高效安全灭菌消毒剂。如图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1:3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
 (1)、实验中控制氯气与空气体积比的方法是。(2)、装置B中多孔球泡和搅拌棒的作用是。(3)、装置B中产生Cl2O的化学方程式为。(4)、若B无冷却装置,则进入C中的Cl2O会大量减少,其原因是。(5)、为避免Cl2影响C中溶液的溶质可以在B、C之间加一个盛有(填试剂名称)的洗气瓶。(6)、已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中次氯酸溶液的物质的量浓度的实验方案为:用(填仪器名称)取20.00mL次氯酸溶液放入烧杯中,向其中(填操作),过滤,洗涤沉淀,在真空干燥箱中干燥,用电子天平称量沉淀质量。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液)
(1)、实验中控制氯气与空气体积比的方法是。(2)、装置B中多孔球泡和搅拌棒的作用是。(3)、装置B中产生Cl2O的化学方程式为。(4)、若B无冷却装置,则进入C中的Cl2O会大量减少,其原因是。(5)、为避免Cl2影响C中溶液的溶质可以在B、C之间加一个盛有(填试剂名称)的洗气瓶。(6)、已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中次氯酸溶液的物质的量浓度的实验方案为:用(填仪器名称)取20.00mL次氯酸溶液放入烧杯中,向其中(填操作),过滤,洗涤沉淀,在真空干燥箱中干燥,用电子天平称量沉淀质量。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液)四、综合题
-
21. 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。(1)、CO2可以被NaOH溶液捕获。若所得溶液c(HCO3-):c(CO32-)=2:1,溶液中由水电离出的c(OH-)=。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)(2)、CO2和H2充入一定体积的密闭容器中,反应过程和在两种温度下CH3OH的物质的量随时间的变化如图1所示。

①已知图1所示反应每消耗1mol H2 , 热量变化是16.3KJ,则反应的热化学方程式为。曲线I、Ⅱ对应的平衡常数大小关系为K1K2(填“>”或“=”或“<”)。
②一定温度下,若此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中密度不变
e.2个C=O断裂的同时有3个H—H断裂
③一定比例的合成气在装有催化剂的反应器中反应12小时,体系中甲醇的产率和催化剂的催化活性与温度的关系如图2所示。

当温度为470K时,图中P点(填“是”或“不是”)处于平衡状态。490K之后,甲醇产率下降的原因是。
(3)、用二氧化碳可合成低密度聚乙烯(LDPE)。常温常压下以纳米二氧化钛膜为工作电极,电解CO2 , 可制得LDPE,可能的机理如下图3所示。
则过程I中阴极电极反应式 , 工业上生产1.4×104g的LDPE,转移电子的物质的量为。
22. 硫、铁的化合物有广泛的应用。(1)、过二硫酸铵(NH4)2S2O8可以看成双氧水的衍生物,H2O2分子中的两个H原子被-SO3H基取代后即为过二硫酸,硫元素的化合价为;(2)、硫铁矿冶炼会产生二氧化硫,通常需要对原料或烟气进行处理,某种脱硫技术的基本原理如下:
则第一步反应的离子方程式为。
(3)、化学反应原理中也涉及到许多硫、铁的化合物。①已知常温下,H2S的电离常数K1=1.0×10-7 , K2=7.0×10-15。0.1mo1·L-1NaHS溶液的pH7(填“>”“=”或“<”),理由是。
②已知25℃时KSP[Fe(OH)3]=4.0×10-38 , 此温度下若在实验室中配制5mo1·L-1100mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入mL 2mol·L-1的盐酸(忽略加入盐酸时溶液体积的变化)。
③FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料,该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2=Fe+2Li2S,正极反应式是。
23. KIO3是一种重要的无机化合物,可作为食盐中的补碘剂,常见制备方法如下。(1)、氯酸钾氧化法:化学反应方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2 , 每生成3mol KH(IO3)2 , 反应中转移的电子数为 , 向反应后溶液中加溶液得到KIO3。(2)、一种由含碘废水制取碘酸钾的工艺如下:
①进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤液中可通过滴加盐溶液来检验其是否已洗涤干净。
②“制FeI2”时,发生反应的化学方程式为。
③在KIO3、KHSO3的酸性混合溶液中加入少量KI(催化剂)和淀粉,不停地搅拌,反应机理为:第一步IO3-+5I-+6H+=3I2+3H2O 第二步反应的离子方程式为。
当反应进行到1.5min时,溶液突然变为蓝色,随之又很快消失,则第步反应速率快。
④改变反应温度,重复上述实验,得到温度(T)与溶液变蓝所需时间(t)的关系如下图所示(超过50℃后溶液不会再变蓝)。根据图像,请你分析温度低于50℃时,溶液变蓝所需时间与反应温度的关系:。
 (3)、山东省已下调食用盐碘含量标准每千克盐含碘25毫克(波动范围为18~33mg·kg-1)。测定食盐试样中碘元素含量的步骤如下:称取4.000g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00mL 6.000×10-4mol· L-1Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理为:
(3)、山东省已下调食用盐碘含量标准每千克盐含碘25毫克(波动范围为18~33mg·kg-1)。测定食盐试样中碘元素含量的步骤如下:称取4.000g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00mL 6.000×10-4mol· L-1Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理为:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-。计算该食盐试样中碘元素的含量mg·kg-1。
-
-