甘肃省宁县2018-2019学年高一上学期化学期末考试试卷
试卷更新日期:2019-02-14 类型:期末考试
一、单选题
-
1. 习主席在十九大报告中指出:“绿水青山就是金山银山。”而利用化学知识降低污染、治理污染,改善人类居住环境是化学工作者当前的首要任务。下列做法不利于环境保护的是( )A、开发清洁能源 B、有效提高能源利用率 C、研制易降解的生物农药 D、对废电池做深埋处理2. “凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次…,价值数倍也”。这里用到的分离方法为( )A、升华 B、蒸馏 C、萃取 D、蒸发3. 环保意识是重要的公民意识。下列气体不属于空气质量日报监测指标的是( )A、SO2 B、CO C、N2 D、NO24. 下列物质的变化,能通过一步化学反应完成的是( )A、Al→Al(OH)3 B、N2→NO2 C、SiO2→Na2SiO3 D、SiO2→H2SiO35. 下列实验操作:①过滤 ②溶解 ③蒸馏 ④取用药品 ⑤萃取 ⑥配制一定浓度的溶液,一定要用到玻璃棒的是( )A、①②⑥ B、②③⑥ C、③④⑥ D、④⑤⑥6. 设NA代表阿伏加德罗常数,下列说法正确的是( )A、5.6 g铁与足量盐酸反应转移的电子数为0.3NA B、常温常压下,11.2L甲烷中含有的氢原子数为2NA C、标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2NA D、常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA7. 砒霜是一种剧毒物质,其主要成分是三氧化二砷(As2O3),根据化学式中元素组成可判断As2O3属于( )A、酸 B、碱 C、酸性氧化物 D、碱性氧化物8. 实验室用下图所示的装置蒸馏海水,下列说法正确的是( )
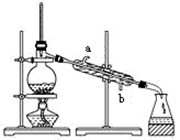 A、蒸馏烧瓶中加入沸石的作用是防止暴沸 B、实验时冷却水应从a进入,从b流出 C、锥形瓶中能收集到高浓度的氯化钠溶液 D、该装置可用于分离海水中的NaCl和MgCl29. 下列试剂贮存方法错误的是( )A、钠应保存在石蜡油或煤油中 B、氢氟酸保存在玻璃瓶中 C、新制氯水保存在棕色试剂瓶中 D、烧碱溶液可用带橡皮塞的玻璃瓶暂时保存10. 在无色溶液中,下列离子能大量共存的是( )A、Mg2+、SO42-、K +、Cl- B、Na+ 、NH4+ 、NO3-、MnO4- C、K + 、Cu2+ 、Cl-、Br- D、Mg2+ 、Na+ 、OH-、HCO3-11. 下列实验不能达到目的的是( )A、用Na2O2与水反应制氧气 B、用Cl2与Ca(OH)2反应制备漂粉精 C、向某无色溶液中加入稀硝酸酸化的BaCl2溶液,产生白色沉淀,以证明原溶液中含有SO42- D、向某溶液加入NaOH并微热,产生使湿润的红色石蕊试纸变蓝的气体,以证明原溶液中有NH4+12. 下列实验操作、实验现象、解释或结论不对应的是( )
A、蒸馏烧瓶中加入沸石的作用是防止暴沸 B、实验时冷却水应从a进入,从b流出 C、锥形瓶中能收集到高浓度的氯化钠溶液 D、该装置可用于分离海水中的NaCl和MgCl29. 下列试剂贮存方法错误的是( )A、钠应保存在石蜡油或煤油中 B、氢氟酸保存在玻璃瓶中 C、新制氯水保存在棕色试剂瓶中 D、烧碱溶液可用带橡皮塞的玻璃瓶暂时保存10. 在无色溶液中,下列离子能大量共存的是( )A、Mg2+、SO42-、K +、Cl- B、Na+ 、NH4+ 、NO3-、MnO4- C、K + 、Cu2+ 、Cl-、Br- D、Mg2+ 、Na+ 、OH-、HCO3-11. 下列实验不能达到目的的是( )A、用Na2O2与水反应制氧气 B、用Cl2与Ca(OH)2反应制备漂粉精 C、向某无色溶液中加入稀硝酸酸化的BaCl2溶液,产生白色沉淀,以证明原溶液中含有SO42- D、向某溶液加入NaOH并微热,产生使湿润的红色石蕊试纸变蓝的气体,以证明原溶液中有NH4+12. 下列实验操作、实验现象、解释或结论不对应的是( )选项
实验操作
实验现象
解释或结论
A
将蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近
产生大量白烟
氨气与氯化氢反应生成固体物质
B
常温下,将洁净的铁片放入浓硫酸或浓硝酸中
无明显变化
常温下,浓硫酸、浓硝酸使铁片钝化
C
在导管口点燃纯净的氢气,然后将导管伸入盛满氯气的集气瓶中
产生苍白色火焰
物质燃烧不一定需要氧气
D
向某无色溶液中滴加盐酸
产生能使澄清石灰水变浑浊气体
说明溶液中一定含有CO32-
A、A B、B C、C D、D13. 下列离子方程式的书写正确的是( )A、铁和稀硫酸反应:2Fe + 6H+ =2Fe 3++3H 2↑ B、NaHCO3溶液与NaOH溶液反应: OH― + HCO3―= CO32― + H2O C、钠和冷水反应 Na+2H2O=Na++2OH-+H2↑ D、氯化铝溶液中加入过量的氨水 Al3+ + 4NH3·H2O =AlO2-+ 4NH4++ 2H2O14. 某试剂瓶上贴有如下标签,对该试剂理解正确的是( ) A、该溶液中含有的微粒主要有:NaCl、Na+、Cl-、H2O B、若取50毫升溶液,其中的c(Cl-)=0.05 mol/L C、若取该溶液与0.1 mol/L AgNO3 100 mL溶液完全反应,需要取该溶液10 mL D、该溶液与1.0mol/LNa2SO4溶液的c(Na+)相等15. 某无色气体,可能含HCl、CO2、HI、SO2中的一种或几种,将其通入氯水中,得到无色透明溶液。把溶液分成两份,向一份中加入盐酸酸化的BaCl2溶液,出现白色沉淀;另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀生成。对于原无色气体推断一定正确的是( )A、一定存在HCl B、一定存在SO2 C、肯定没有CO2 D、不能肯定是否含有HI16. 氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C 2AlN+3CO合成。下列叙述错误的是( )A、AlN中N元素显-3价 B、上述反应中,Al2O3是氧化剂 C、上述反应中N2被还原 D、上述反应中碳发生氧化反应
A、该溶液中含有的微粒主要有:NaCl、Na+、Cl-、H2O B、若取50毫升溶液,其中的c(Cl-)=0.05 mol/L C、若取该溶液与0.1 mol/L AgNO3 100 mL溶液完全反应,需要取该溶液10 mL D、该溶液与1.0mol/LNa2SO4溶液的c(Na+)相等15. 某无色气体,可能含HCl、CO2、HI、SO2中的一种或几种,将其通入氯水中,得到无色透明溶液。把溶液分成两份,向一份中加入盐酸酸化的BaCl2溶液,出现白色沉淀;另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀生成。对于原无色气体推断一定正确的是( )A、一定存在HCl B、一定存在SO2 C、肯定没有CO2 D、不能肯定是否含有HI16. 氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C 2AlN+3CO合成。下列叙述错误的是( )A、AlN中N元素显-3价 B、上述反应中,Al2O3是氧化剂 C、上述反应中N2被还原 D、上述反应中碳发生氧化反应二、填空题
-
17.(1)、现有物质:①NaCl晶体 ②CO2 ③氨水 ④蔗糖 ⑤BaSO4固体 ⑥铜 ⑦熔融的KNO3
试回答(填序号):能导电的是;属于电解质的是。
(2)、一定量的金属铝跟足量NaOH溶液反应,放出3.36LH2(标准状况下),则该铝的质量是g,如反应后溶液的体积为500mL,则反应后溶液中NaAlO2的物质的量浓度为mol/L。(3)、同温同压下的两个相同容器中分别装有NO和NO2气体,则两瓶气体中,质量之比是 , 分子数之比是。(4)、设NA表示阿伏加德罗常数,如果x g某气体含有的分子数是y , 则z g该气体在标准状况下的体积是L(用含NA的式子表示)。18. 中国科学院官方微信于2017年3月发表《灰霾专题》,提出灰霾中细颗粒物的成因,部分分析如下图所示。 (1)、根据上图信息可以看出,下列哪种气体污染物不是由机动车行驶造成的 ,
(1)、根据上图信息可以看出,下列哪种气体污染物不是由机动车行驶造成的 ,a.SO2
b.NOx
c.VOCs
d. NH3
(2)、机动车大量行驶是污染源之一。汽车发动机废气稀燃控制系统主要工作原理如图所示;写出稀燃过程中NO发生的主要反应的方程式。 (3)、SO2是气体污染物的主要成分之一。作为一种化学性质活泼的物质,它能发生多种反应,请按照下表提示,从不同角度梳理SO2不同类的化学性质,将化学方程式填在下表中。
(3)、SO2是气体污染物的主要成分之一。作为一种化学性质活泼的物质,它能发生多种反应,请按照下表提示,从不同角度梳理SO2不同类的化学性质,将化学方程式填在下表中。SO2性质梳理
化学方程式
物质类别
酸性氧化物
①SO2 +H2O H2SO3
②SO2 + CaO = CaSO3
③
S元素
价态
S为+4价
①
② SO2 + 2H2S = 3S + 2H2O
(4)、科学家经过研究发现中国霾呈中性,其主要原因如图所示:
请判断A的化学式并说明判断理由:。
三、实验题
-
19. 工业上利用电解饱和食盐水生产氯气(Cl2)、烧碱和氢气的化学方程式是:2NaCl + 2H2O NaOH + Cl2↑+ H2↑(1)、用双线桥表示出电子转移的方向和数目题干中反应改写成离子方程式是(2)、电解食盐水的过程中,氧化产物是(3)、电解食盐水要求对粗食盐水进行精制,以除去租食盐水中含有的泥沙和SO42-、Ca2+ , Mg2+等杂质离子。精制时依次加入氯化钡溶液、纯碱、烧碱,充分反应后过滤,在滤液中加入盐酸中和至中性。盐酸与滤液反应的离子方程式: , .(4)、实验室欲用固体NaOH来配制90mL 0.5 mol/L的NaOH溶液来用于以上除杂,需要称量固体NaOHg。配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。其正确的操作顺序为。在配制过程中,若其它操作均正确,下列操作会引起结果偏低的是(填字母)。
A.没有洗涤烧杯和玻璃棒
B.未等NaOH溶液冷却至室温就转移到容量瓶中定容
C.容量瓶不干燥,含有少量蒸馏水
四、综合题
-
20. 用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2 , 装置如下图所示。
 (1)、B中选用的试剂是 , 其作用是;C中选用的试剂的作用是(2)、D中反应的化学方程式是(3)、某学生应用如图所示的方法研究物质的性质,其中气体X的主要成分是氯气。回答下列问题:
(1)、B中选用的试剂是 , 其作用是;C中选用的试剂的作用是(2)、D中反应的化学方程式是(3)、某学生应用如图所示的方法研究物质的性质,其中气体X的主要成分是氯气。回答下列问题:
① 与研究目的直接相关的B、C中的实验现象是。
② 如果通入气体中混有SO2 , 能否看到相同的现象? (填“能”、“不能”或者“”“不能确定”),用化学方程式进行解释:
③从物质性质的方面来看,这样的实验设计还存在事故隐患,事故表现是最后缺少一个装置,用化学方程式解释其原理
五、计算题
-
21.(1)、Ⅰ.把5.1 g镁铝合金的粉末放入过量的盐酸中,得到5.6 L H2(标准状况下)。
合金中镁的物质的量为。
(2)、写出该合金溶于足量NaOH溶液的化学方程式:。(3)、Ⅱ.在一定质量的AlCl3和MgCl2混合溶液中逐渐滴入一定溶质质量分数的NaOH溶液,生成沉淀的物质的量与加入NaOH的物质的量的关系如图所示。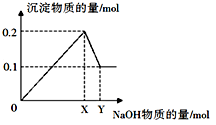
生成Mg(OH)2的质量为。
(4)、X=;Y=。
-
-